L'aluminium brûle-t-il dans un feu ouvert ? Comment obtenir une couleur de flamme uniforme ? Combustion d'alliages aluminium-magnésium dans l'air
Il n'est pas difficile de deviner que la teinte d'une flamme est déterminée par les produits chimiques qui y brûlent, si l'exposition à une température élevée libère des atomes individuels de substances combustibles, colorant le feu. Pour déterminer l'effet des substances sur la couleur du feu, diverses expériences ont été réalisées, dont nous parlerons ci-dessous.
Depuis l'Antiquité, les alchimistes et les scientifiques tentent de découvrir quelles substances brûlent, en fonction de la couleur que prend la flamme.
Les flammes des chauffe-eau et des poêles à gaz, disponibles dans toutes les maisons et appartements, ont une teinte bleue. Lorsqu'elle est brûlée, cette teinte est produite par le carbone, le monoxyde de carbone. La couleur jaune-orange de la flamme d'un feu allumé en forêt ou d'allumettes domestiques est due à la teneur élevée en sels de sodium du bois naturel. En grande partie grâce à cela - le rouge. La flamme d'un brûleur de cuisinière à gaz acquerra la même couleur si vous la saupoudrez de sel de table ordinaire. Lorsque le cuivre brûle, la flamme devient verte. Je pense que vous avez remarqué que lorsque vous portez longtemps une bague ou une chaîne en cuivre ordinaire qui n'est pas recouverte d'un composé protecteur, la peau devient verte. La même chose se produit pendant le processus de combustion. Si la teneur en cuivre est élevée, une lumière verte très brillante apparaît, presque identique au blanc. Cela peut être vu si vous saupoudrez des copeaux de cuivre sur un brûleur à gaz.
De nombreuses expériences ont été réalisées en utilisant un brûleur à gaz ordinaire et divers minéraux. Leur composition a ainsi été déterminée. Vous devez prendre le minéral avec une pince à épiler et le placer dans la flamme. La couleur que prend le feu peut indiquer les différentes impuretés présentes dans l’élément. Une flamme verte et ses nuances indiquent la présence de cuivre, de baryum, de molybdène, d'antimoine et de phosphore. Le bore produit une couleur bleu-vert. Le sélénium donne à la flamme une teinte bleue. La flamme est colorée en rouge en présence de strontium, de lithium et de calcium, et en violet - potassium. La couleur jaune-orange est produite lorsque le sodium brûle.
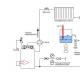
Les études des minéraux pour déterminer leur composition sont réalisées à l'aide d'un bec Bunsen. La couleur de sa flamme est uniforme et incolore ; elle ne gêne pas le déroulement de l'expérience. Bunsen a inventé le brûleur au milieu du XIXe siècle.
Il a mis au point une méthode qui permet de déterminer la composition d'une substance par la teinte de la flamme. Des scientifiques avaient tenté de mener des expériences similaires avant lui, mais ils ne disposaient pas de bec Bunsen dont la flamme incolore ne gênait pas le déroulement de l'expérience. Il a placé divers éléments sur un fil de platine dans le feu du brûleur, car lorsque ce métal est ajouté, la flamme ne se colore pas. À première vue, la méthode semble bonne : on peut se passer d'une analyse chimique fastidieuse. Il suffit d'amener l'élément au feu et de voir de quoi il s'agit. Mais les substances sous leur forme pure se trouvent extrêmement rarement dans la nature. Ils contiennent généralement de grandes quantités d’impuretés diverses qui modifient la couleur de la flamme.
Bunsen a essayé de mettre en valeur les couleurs et les nuances en utilisant diverses méthodes. Par exemple, en utilisant du verre coloré. Disons que si vous regardez à travers un verre bleu, vous ne verrez pas la couleur jaune que prend le feu lors de la combustion des sels de sodium les plus courants. Ensuite, la teinte lilas ou cramoisie de l'élément souhaité devient distincte. Mais même de telles astuces ont permis dans de très rares cas de déterminer correctement la composition d'un minéral complexe. Cette technologie ne pourrait pas faire plus.
De nos jours, une telle torche n'est utilisée que pour le soudage.
Les flammes sont de différentes couleurs. Regardez dans la cheminée. Des flammes jaunes, oranges, rouges, blanches et bleues dansent sur les bûches. Sa couleur dépend de la température de combustion et du matériau combustible. Pour visualiser cela, imaginez la spirale d'une cuisinière électrique. Si le carreau est éteint, les tours en spirale sont froids et noirs. Disons que vous décidez de réchauffer la soupe et d'allumer le feu. Au début, la spirale devient rouge foncé. Plus la température augmente, plus la couleur rouge de la spirale est brillante. Lorsque le carreau atteint sa température maximale, la bobine devient rouge orangé.
Naturellement, la spirale ne brûle pas. Vous ne voyez pas la flamme. Elle est juste vraiment sexy. Si vous le chauffez davantage, la couleur changera. Tout d'abord, la couleur de la spirale deviendra jaune, puis blanche, et lorsqu'elle se réchauffera encore plus, une lueur bleue en émanera.

Quelque chose de similaire se produit avec le feu. Prenons l'exemple d'une bougie. Différentes zones de la flamme d’une bougie ont des températures différentes. Le feu a besoin d'oxygène. Si vous couvrez une bougie avec un bocal en verre, le feu s'éteindra. La zone centrale de la flamme de la bougie adjacente à la mèche consomme peu d'oxygène et apparaît sombre. Les zones supérieures et latérales de la flamme reçoivent plus d’oxygène, ces zones sont donc plus lumineuses. Au fur et à mesure que la flamme traverse la mèche, la cire fond et crépite, se brisant en minuscules particules de carbone. (Le charbon est également constitué de carbone.) Ces particules sont transportées vers le haut par la flamme et brûlent. Ils sont très chauds et brillent comme la spirale de votre carrelage. Mais les particules de carbone sont beaucoup plus chaudes que le serpentin de la tuile la plus chaude (la température de combustion du carbone est d'environ 1 400 degrés Celsius). Leur éclat est donc jaune. Près de la mèche allumée, la flamme est encore plus chaude et brille en bleu.
Les flammes d’une cheminée ou d’un feu sont pour la plupart d’apparence hétéroclite. Le bois brûle à une température plus basse qu’une mèche de bougie, la couleur de base du feu est donc orange plutôt que jaune. Certaines particules de carbone présentes dans une flamme de feu ont une température assez élevée. Il y en a peu, mais ils ajoutent une teinte jaunâtre à la flamme. Les particules refroidies de charbon chaud sont de la suie qui se dépose sur les cheminées. La température de combustion du bois est inférieure à la température de combustion d’une bougie. Le calcium, le sodium et le cuivre, lorsqu'ils sont chauffés à des températures élevées, brillent de différentes couleurs. Ils sont ajoutés à la poudre de fusée pour colorer les lumières des feux d’artifice des fêtes.
Couleur de la flamme et composition chimique
La couleur de la flamme peut varier en fonction des impuretés chimiques contenues dans les bûches ou autre substance inflammable. La flamme peut contenir par exemple des impuretés de sodium.

Même dans les temps anciens, les scientifiques et les alchimistes essayaient de comprendre quels types de substances brûlaient dans le feu, en fonction de la couleur du feu.
- Le sodium est un composant du sel de table. Lorsque le sodium est chauffé, il devient jaune vif.
- Du calcium peut être libéré dans le feu. Nous savons tous que le lait contient beaucoup de calcium. C'est du métal. Le calcium chaud devient rouge vif.
- Si le phosphore brûle dans un incendie, la flamme deviendra verdâtre. Tous ces éléments sont soit contenus dans le bois, soit entrent dans le feu avec d'autres substances.
- Presque tout le monde à la maison possède une cuisinière à gaz ou un chauffe-eau dont les flammes sont de couleur bleue. Cela est dû au carbone combustible, le monoxyde de carbone, qui donne cette teinte.

Mélanger les couleurs d'une flamme, comme mélanger les couleurs d'un arc-en-ciel, peut produire du blanc, c'est pourquoi des zones blanches sont visibles dans les flammes d'un feu ou d'une cheminée.
Température de la flamme lors de la combustion de certaines substances :
Comment obtenir une couleur de flamme uniforme ?
Pour étudier les minéraux et déterminer leur composition, on utilise bec Bunsen, donnant une couleur de flamme uniforme et incolore qui ne gêne pas le déroulement de l'expérience inventée par Bunsen au milieu du XIXe siècle.

Bunsen était un fervent fan de l’élément feu et bricolait souvent les flammes. Son passe-temps était le soufflage de verre. En soufflant diverses conceptions et mécanismes astucieux dans du verre, Bunsen n'a pas pu remarquer la douleur. Il y avait des moments où ses doigts calleux commençaient à fumer à cause du verre chaud et encore mou, mais il n'y prêtait pas attention. Si la douleur avait déjà dépassé le seuil de sensibilité, il s'est alors sauvé en utilisant sa propre méthode - il a pressé fermement son lobe d'oreille avec ses doigts, interrompant une douleur par une autre.
C'est lui qui fut le fondateur de la méthode permettant de déterminer la composition d'une substance par la couleur de la flamme. Bien sûr, avant lui, les scientifiques ont essayé de mener de telles expériences, mais ils ne disposaient pas d'un bec Bunsen avec une flamme incolore qui n'interférerait pas avec l'expérience. Il a introduit divers éléments sur du fil de platine dans la flamme du brûleur, car le platine n'affecte pas la couleur de la flamme et ne la colore pas.
Il semblerait que la méthode soit bonne, aucune analyse chimique complexe n'est nécessaire : portez l'élément à la flamme et sa composition est immédiatement visible. Mais ce n'était pas là. Très rarement, les substances se trouvent dans la nature sous leur forme pure, elles contiennent généralement une large gamme d'impuretés diverses qui changent de couleur.
Bunsen a essayé diverses méthodes pour isoler les couleurs et leurs nuances. Par exemple, j'ai essayé de regarder à travers du verre coloré. Supposons que le verre bleu éteigne la couleur jaune produite par les sels de sodium les plus courants, et on pourrait discerner une teinte cramoisie ou violette de l'élément natif. Mais même avec l'aide de ces astuces, il n'a été possible de déterminer la composition d'un minéral complexe qu'une fois sur cent.
C'est intéressant! En raison de la propriété des atomes et des molécules d'émettre une lumière d'une certaine couleur, une méthode a été développée pour déterminer la composition des substances, appelée analyse spectrale. Les scientifiques étudient le spectre qu'émet une substance, par exemple lorsqu'elle brûle, le comparent aux spectres d'éléments connus et déterminent ainsi sa composition.

Brûlure d'aluminium
L'aluminium brûle dans l'air
Contrairement au magnésium, les particules d'aluminium ne s'enflamment pas lorsqu'elles sont chauffées dans l'air ou la vapeur d'eau jusqu'à 2 100 K. Des particules de magnésium en feu ont été utilisées pour enflammer l’aluminium. Ces derniers ont été placés sur la surface de l'élément chauffant et les particules d'aluminium ont été placées sur la pointe de l'aiguille à une distance de 10 à 4 m au-dessus des premières.
Lorsque des particules d'aluminium s'enflamment, l'inflammation se produit en phase vapeur et l'intensité de la zone lumineuse qui apparaît autour de la particule augmente lentement. La combustion stationnaire se caractérise par l'existence d'une zone incandescente, qui ne change de taille que lorsque le métal est presque complètement brûlé. Le rapport entre les tailles de la zone lumineuse et la particule est de 1,6 à 1,9. Dans la zone lumineuse, de petites gouttelettes d'oxyde se forment, qui fusionnent lors d'une collision.
Le résidu après combustion de la particule est une coque creuse ne contenant aucun métal à l’intérieur. La dépendance du temps de combustion d'une particule sur sa taille est exprimée par la formule (combustion symétrique).
Combustion de l'aluminium dans la vapeur d'eau
L'inflammation de l'aluminium dans la vapeur d'eau se produit de manière hétérogène. L'hydrogène libéré lors de la réaction contribue à la destruction du film d'oxyde ; dans ce cas, de l'oxyde (ou hydroxyde) d'aluminium liquide est pulvérisé sous forme de gouttelettes d'un diamètre allant jusqu'à 10-15 microns. Une telle destruction de la coque d'oxyde est périodiquement répétée. Cela suggère qu’une fraction importante du métal brûle à la surface de la particule.
Au début de la combustion, le rapport rsv /r 0 est égal à 1,6-1,7. Au cours du processus de combustion, la taille des particules diminue et le rapport gs/?o augmente jusqu'à 2,0-3,0. La vitesse de combustion d'une particule d'aluminium dans la vapeur d'eau est presque 5 fois supérieure à celle dans l'air.
Combustion d'alliages aluminium-magnésium
Combustion d'alliages aluminium-magnésium dans l'air
L'inflammation de particules d'alliages aluminium-magnésium de composition variable dans l'air, les mélanges oxygène-argon, la vapeur d'eau et le dioxyde de carbone se déroule, en règle générale, de la même manière que l'inflammation des particules de magnésium. Le début de l'inflammation est précédé de réactions oxydatives se produisant en surface.
La combustion des alliages aluminium-magnésium diffère considérablement de la combustion de l'aluminium et du magnésium et dépend fortement du rapport des composants dans l'alliage et des paramètres de l'environnement oxydant. La caractéristique la plus importante de la combustion des particules d'alliage est le processus en deux étapes (Fig. 2.6). Dans un premier temps, la particule est entourée d'un ensemble de torches, formant une zone non uniforme de luminescence des produits de réaction. En comparant la nature et la taille de la zone lumineuse entourant la particule d'alliage lors de la première étape de combustion avec la nature et la taille de la zone lumineuse autour de la particule de magnésium en combustion (voir Fig. 2.4), nous pouvons conclure qu'à ce stade, principalement du magnésium brûle de la particule.

Riz. 2.6. Combustion d'une particule d'alliage de 30% Al + 70% Mg à pression atmosphérique normale dans un mélange contenant 15% O en volume 2et 85% Ar :
1, 2 – épuisement du magnésium; 3-6 – grillage de l'aluminium
Une caractéristique de la première étape de la combustion des alliages est la constance de la taille des particules et de la zone de flamme. Cela signifie que la goutte liquide de l’alliage est contenue dans une coque d’oxyde solide. Le film d'oxyde est dominé par l'oxyde de magnésium. À travers les défauts du film, le magnésium s'écoule et brûle dans une flamme de diffusion en phase vapeur.
A la fin de la première étape, l'apparition de réactions hétérogènes augmente, comme en témoigne l'apparition de zones de luminescence vive à la surface de la particule. La chaleur dégagée lors de réactions hétérogènes contribue à chauffer la particule jusqu'au point de fusion de l'oxyde et au début de la deuxième étape de combustion.
Lors de la deuxième étape de combustion, la particule est entourée d’une zone de lueur uniforme et plus brillante, qui diminue à mesure que le métal brûle. L'homogénéité et la sphéricité de la zone de flamme indiquent que le film d'oxyde à la surface de la particule est fondu. La diffusion du métal à travers le film est assurée par la faible résistance à la diffusion de l'oxyde liquide. La taille de la zone de flamme dépasse largement la taille des particules, ce qui indique la combustion du métal en phase vapeur. La comparaison de la nature de la deuxième étape de combustion avec le schéma connu de combustion de l'aluminium indique une grande similitude ; il est probable que l'aluminium brûle à ce stade du processus. Au fur et à mesure qu'elle brûle, la taille de la flamme et, par conséquent, la goutte brûlante diminuent. La particule brûlée brille longtemps.
Changer la taille de la zone lumineuse d'une particule brûlant conformément au mécanisme décrit est complexe (Fig. 2.7). Après allumage la valeur r St. /r 0 atteint rapidement (en -0,1 ms) la valeur maximale (section un B). De plus, pendant la durée principale de la première étape de combustion, le rapport r St/ r 0 reste constant (section bv). Lorsque l’épuisement du magnésium prend fin, r CV/ r 0 est réduit au minimum (point G), puis, avec le début de la combustion de l'aluminium, elle augmente (section dieu). Enfin, mais comme l'aluminium brûle r St. /r 0 diminue de façon monotone (section de) à une valeur finale correspondant à la taille de l'oxyde formé.

Riz. 2.7.:
1 – alliage 30% Al + 70% Mg, air ; 2 – alliage 30% A1 + 70% Mg, mélange 15% O2 + 85% Ar ; 3 – alliage 50% A1 + 50% Mg, air
Le mécanisme et les paramètres du processus de combustion des alliages aluminium-magnésium dépendent largement de la composition de l'alliage. Avec une diminution de la teneur en magnésium dans l'alliage, la taille de la zone incandescente lors de la première étape de combustion et la durée de cette étape diminuent. Lorsque la teneur en magnésium de l’alliage est inférieure à 30 %, le processus reste un processus en deux étapes, mais devient intermittent. À la fin de la première étape, la zone incandescente est réduite à la taille de la particule elle-même, le processus de combustion s'arrête et l'aluminium ne brûle qu'après le rallumage de la particule. Les particules qui ne s'enflamment plus sont des coquilles d'oxyde creuses et poreuses contenant des gouttelettes d'aluminium non brûlé à l'intérieur.
La dépendance du temps de combustion des particules sur leur diamètre initial est exprimée par les formules empiriques suivantes :

Combustion d'alliages aluminium-magnésium dans des mélanges d'oxygène avec de l'argon, dans de la vapeur d'eau et dans du dioxyde de carbone.
La nature de la combustion des particules d'alliages aluminium-magnésium dans les mélanges oxygène-argon est la même que dans l'air. Avec une diminution de la teneur en oxygène, la taille de la zone lumineuse lors de l'épuisement du magnésium diminue sensiblement. La dépendance du temps de combustion des particules de l'alliage 50 % Al + 50 % Mg sur la taille des particules et la teneur en oxygène dans le mélange en pourcentage volumique est exprimée par la formule
La combustion des alliages dans la vapeur d'eau est sensiblement différente (Fig. 2.8). Le film d’oxyde formé lors de la première étape est détruit par l’hydrogène et la particule prend l’apparence d’un corail. L'aluminium restant dans le corail s'enflamme seulement 1 à 10 ms après la fin de la première étape. Une telle intermittence du processus est typique pour les alliages de toute composition.

Riz. 2.8. Combustion de particules d'alliage aluminium-magnésium (50:50) sphériques(UN) et faux(b) se forme dans la vapeur d'eau à pression atmosphérique normale :
1 – particule initiale ; 2 – particule avant inflammation ; 3 – épuisement du magnésium ; 4 – grillage de l'aluminium ; 5 – corail formé après la particule
Lorsque les alliages aluminium-magnésium brûlent dans le dioxyde de carbone, seul le magnésium brûle des particules, après quoi le processus de combustion s'arrête.
Combustion d'alliages aluminium-magnésium dans une flamme à haute température
Pour étudier le processus de combustion de particules métalliques à haute température, un comprimé pressé de mélanges de perchlorate d'ammonium et d'hexamine, ayant calculé des températures de combustion de 2 500, 2 700 et 3 100 K, a été brûlé sous une particule montée sur la pointe d'une aiguille.
La combustion de particules d'alliages aluminium-magnésium dans ces conditions se produit généralement avec une explosion. La présence d'une explosion est typique pour les particules de toutes compositions. À la suite de l'explosion, une zone de luminescence importante se forme, signe de la prédominance de la combustion en phase vapeur. Photographies d'une particule en feu au début de la combustion (Fig. 2.9, UN) montrent que des réactions hétérogènes se produisent sur toute la surface de la coque d'oxyde. En raison de la chaleur des réactions hétérogènes, une évaporation rapide du métal se produit (Fig. 2.9, b), favorisant la rupture de la coque d'oxyde et l'éclaboussement de la goutte non évaporée (Fig. 2.9, V).

Riz. 2.9. Combustion de particules d'alliage d'aluminium à 95 % avec 5% Mg en flamme comburante (température 2700 K) :
UN– étape initiale de combustion ; b– combustion stationnaire ; V- Se séparer
Selon B. G. Lrabey, S. E. Salibekov et Yu. V. Leninsky, le broyage des particules d'alliages aluminium-magnésium est provoqué par une très grande différence dans les températures d'ébullition du magnésium et de l'aluminium, ce qui entraîne l'ébullition du magnésium lorsque la particule se trouve dans une zone à haute température est explosif et conduit à l'écrasement de l'aluminium restant. Une température de 2500 K est déjà suffisante pour qu'une combustion explosive se produise, ce qui est tout à fait naturel, puisque cette température dépasse le point d'ébullition des deux composants.
- Arabey B.G., Salibekov S.E., Levinsky Yu.V. Quelques caractéristiques d'inflammation et de combustion des poussières métalliques // Métallurgie des poudres. 1964. N° 3. P. 109-118.
Pour formuler les lois des processus en cours, on peut se limiter à considérer les cations et exclure les anions, puisqu'ils ne participent pas eux-mêmes à la réaction. (Cependant, la vitesse de dépôt est affectée par le type d'anions.) Si, par souci de simplicité, nous supposons que les métaux libérés et dissous sont divalents, alors nous pouvons écrire :
Moi 1 + Moi 2 2+ => Moi 1 2+ + Moi 2
De plus, pour la première expérience Me 1 = Fe, Me 2 = Cu. Ainsi, le processus consiste en l’échange de charges (électrons) entre les atomes et les ions des deux métaux. Si l'on considère séparément (comme réactions intermédiaires) la dissolution du fer ou la précipitation du cuivre, on obtient :
Fe => Fe 2+ + 2e -
Сu 2+ + 2е - => Сu
Considérons maintenant le cas où un métal est immergé dans l'eau ou dans une solution saline, avec un cation dont l'échange est impossible du fait de sa position dans la série de contraintes. Malgré cela, le métal a tendance à se dissoudre sous forme d’ion. Dans ce cas, l'atome métallique cède deux électrons (si le métal est divalent), la surface du métal immergée dans la solution devient chargée négativement par rapport à la solution et une double couche électrique se forme à l'interface. Cette différence de potentiel empêche une dissolution ultérieure du métal, de sorte que le processus s'arrête rapidement. Si deux métaux différents sont immergés dans une solution, ils se chargeront tous les deux, mais le moins actif sera un peu plus faible, car ses atomes sont moins enclins à perdre des électrons. Connectons les deux métaux avec un conducteur. En raison de la différence de potentiel, un flux d’électrons circulera du métal le plus actif vers le métal le moins actif, qui forme le pôle positif de l’élément. Un processus se produit dans lequel le métal le plus actif entre en solution et les cations de la solution sont libérés sur le métal le plus noble.
L'essence d'une cellule galvanique
Illustrons maintenant par quelques expériences le raisonnement quelque peu abstrait exposé ci-dessus (qui représente d'ailleurs une grossière simplification).
Tout d'abord, remplissez un bécher de 250 ml jusqu'au milieu avec une solution à 10 % d'acide sulfurique et plongez-y des morceaux de zinc et de cuivre pas trop petits. Nous soudons ou rivetons du fil de cuivre aux deux électrodes, dont les extrémités ne doivent pas toucher la solution.
Tant que les extrémités du fil ne sont pas reliées entre elles, on observera la dissolution du zinc, qui s'accompagne d'un dégagement d'hydrogène. Le zinc, comme le montre la série de tensions, est plus actif que l'hydrogène, de sorte que le métal peut déplacer l'hydrogène de l'état ionique. Une double couche électrique est formée sur les deux métaux. Le moyen le plus simple de détecter la différence de potentiel entre les électrodes consiste à utiliser un voltmètre. Immédiatement après avoir connecté l'appareil au circuit, la flèche indiquera environ 1 V, mais la tension chutera ensuite rapidement. Si vous connectez une petite ampoule qui consomme 1 V à l'élément, elle s'allumera - d'abord assez fortement, puis la lueur deviendra faible.
Sur la base de la polarité des bornes de l'appareil, nous pouvons conclure que l'électrode de cuivre est le pôle positif. Cela peut être prouvé sans appareil en considérant l’électrochimie du processus. Préparons une solution saturée de sel de table dans un petit bécher ou un tube à essai, ajoutons environ 0,5 ml d'une solution alcoolique de l'indicateur de phénolphtaléine et plongeons les deux électrodes fermées par du fil dans la solution. Une légère couleur rougeâtre sera observée près du pôle négatif, provoquée par la formation d’hydroxyde de sodium à la cathode.
Dans d’autres expériences, on peut placer différentes paires de métaux dans une cellule et déterminer la tension résultante. Par exemple, le magnésium et l'argent donneront une différence de potentiel particulièrement grande en raison de la distance importante qui les sépare d'une série de tensions, tandis que le zinc et le fer, au contraire, en donneront une très petite, inférieure à un dixième de volt. En utilisant de l’aluminium, nous ne recevrons pratiquement aucun courant grâce à la passivation.
Tous ces éléments, ou, comme disent les électrochimistes, ces circuits, présentent l'inconvénient que lors de la mesure du courant, la tension à leurs bornes chute très rapidement. Par conséquent, les électrochimistes mesurent toujours la valeur réelle de la tension à l'état hors tension en utilisant la méthode compensation de tension, c'est-à-dire en le comparant avec la tension d'une autre source de courant.
Considérons les processus dans l'élément cuivre-zinc plus en détail. A la cathode, le zinc entre en solution selon l'équation suivante :
Zn => Zn 2+ + 2е -
Les ions hydrogène de l'acide sulfurique sont évacués au niveau de l'anode en cuivre. Ils attachent les électrons traversant le fil depuis la cathode de zinc et, par conséquent, des bulles d'hydrogène se forment :
2Н + + 2е - => Н 2
Après un court laps de temps, le cuivre sera recouvert d’une fine couche de bulles d’hydrogène. Dans ce cas, l'électrode de cuivre se transformera en électrode d'hydrogène et la différence de potentiel diminuera. Ce processus est appelé polarisationélectrode. La polarisation de l'électrode de cuivre peut être éliminée en ajoutant un peu de solution de bichromate de potassium à la cellule après la chute de tension. Après cela, la tension augmentera à nouveau, car le bichromate de potassium oxydera l'hydrogène en eau. Le dichromate de potassium agit dans ce cas comme dépolariseur
En pratique, on utilise des circuits galvaniques dont les électrodes ne sont pas polarisées, ou des circuits dont la polarisation peut être supprimée par l'ajout de dépolariseurs.
À titre d'exemple d'élément non polarisable, considérons l'élément Daniel, qui était souvent utilisé dans le passé comme source de courant. Il s'agit également d'un élément cuivre-zinc, mais les deux métaux sont immergés dans des solutions différentes. L'électrode de zinc est placée dans une cellule d'argile poreuse remplie d'acide sulfurique dilué (environ 20 %). La cellule d'argile est suspendue dans un grand verre contenant une solution concentrée de sulfate de cuivre, et au fond se trouve une couche de cristaux de sulfate de cuivre. La deuxième électrode de ce récipient est un cylindre en feuille de cuivre.
Cet élément peut être réalisé à partir d'un bocal en verre, d'une cellule en argile disponible dans le commerce (en dernier recours, on utilise un pot de fleur en fermant le trou au fond) et de deux électrodes de taille adaptée.
Pendant le fonctionnement de la cellule, le zinc se dissout pour former du sulfate de zinc et du cuivre métallique est libéré au niveau de l'électrode de cuivre. Mais en même temps, l'électrode de cuivre n'est pas polarisée et l'élément produit une tension d'environ 1 V. En fait, théoriquement, la tension aux bornes est de 1,10 V, mais lors de la collecte de courant, nous mesurons une valeur légèrement inférieure en raison de la tension électrique. résistance de la cellule.
Si nous ne supprimons pas le courant de l’élément, nous devons retirer l’électrode de zinc de la solution d’acide sulfurique, sinon elle se dissoudra pour former de l’hydrogène.
Un schéma d'une cellule simple ne nécessitant pas de cloison poreuse est présenté sur la figure. L'électrode de zinc est située en haut du bocal en verre et l'électrode de cuivre est située près du fond. La cellule entière est remplie d'une solution saturée de sel de table. Placez une poignée de cristaux de sulfate de cuivre au fond du pot. La solution concentrée de sulfate de cuivre résultante se mélangera très lentement à la solution de sel de table. Ainsi, lorsque la cellule fonctionnera, du cuivre sera libéré sur l’électrode en cuivre, et le zinc se dissoudra sous forme de sulfate ou de chlorure dans la partie supérieure de la cellule.
De nos jours, ils sont utilisés presque exclusivement pour les batteries. éléments secs, qui sont plus pratiques à utiliser. Leur ancêtre est l'élément Leclanche. Les électrodes sont un cylindre de zinc et une tige de carbone. L'électrolyte est une pâte composée principalement de chlorure d'ammonium. Le zinc se dissout dans la pâte et de l'hydrogène se dégage sur le charbon. Pour éviter la polarisation, la tige de carbone est plongée dans un sac en lin contenant un mélange de poudre de charbon et de pyrolusite. La poudre de carbone augmente la surface de l'électrode et la pyrolusite agit comme un dépolarisant, oxydant lentement l'hydrogène. Certes, la capacité dépolarisante de la pyrolusite est plus faible que celle du bichromate de potassium mentionné précédemment. Par conséquent, lorsque le courant est reçu dans des éléments secs, la tension chute rapidement, ils se « fatiguent » à cause de la polarisation. Ce n'est qu'après un certain temps que l'oxydation de l'hydrogène se produit avec la pyrolusite. Ainsi, les éléments se « reposent » si aucun courant ne passe pendant un certain temps. Vérifions cela sur une batterie de lampe de poche à laquelle nous connectons une ampoule. Nous connectons un voltmètre parallèlement à la lampe, c'est-à-dire directement aux bornes. Au début, la tension sera d'environ 4,5 V. (Le plus souvent, ces batteries ont trois cellules connectées en série, chacune avec une tension théorique de 1,48 V.) Après un certain temps, la tension chutera et la lueur de l'ampoule s'allumera. affaiblir. Sur la base des lectures du voltmètre, nous pouvons juger de la durée pendant laquelle la batterie doit se reposer.
Une place particulière est occupée par les éléments régénérateurs appelés batteries. Ils subissent des réactions réversibles et peuvent être rechargés après décharge de la cellule en se connectant à une source DC externe.
Actuellement, les batteries au plomb sont les plus courantes ; L'électrolyte qu'ils contiennent est de l'acide sulfurique dilué, dans lequel sont immergées deux plaques de plomb. L'électrode positive est recouverte de peroxyde de plomb PbO 2 (le nom moderne est dioxyde de plomb), l'électrode négative est en plomb métallique. La tension aux bornes est d'environ 2,1 V. Lors de la décharge, du sulfate de plomb se forme sur les deux plaques, qui se transforme à nouveau en plomb métallique et en peroxyde de plomb lors de la charge.