هل يحترق الألمنيوم في النار المفتوحة؟ كيفية الحصول على لون لهب متساوي؟ احتراق سبائك الألومنيوم والمغنيسيوم في الهواء
ليس من الصعب تخمين أن لون اللهب يتحدد من خلال المواد الكيميائية المشتعلة فيه، إذا كان التعرض لدرجة حرارة عالية يؤدي إلى إطلاق ذرات فردية من المواد القابلة للاحتراق، مما يؤدي إلى تلوين النار. لتحديد تأثير المواد على لون النار، تم إجراء تجارب مختلفة، والتي سنناقشها أدناه.
منذ العصور القديمة، حاول الكيميائيون والعلماء معرفة المواد التي تحترق، اعتمادًا على اللون الذي يكتسبه اللهب.
لهيب سخانات المياه ومواقد الغاز المتوفرة في جميع المنازل والشقق لها لون أزرق. عند حرق هذا الظل يتم إنتاجه بواسطة الكربون، أول أكسيد الكربون. اللون الأصفر البرتقالي لهب النار المشتعلة في الغابة، أو أعواد الثقاب المنزلية، يرجع إلى المحتوى العالي من أملاح الصوديوم في الخشب الطبيعي. إلى حد كبير بفضل هذا - الأحمر. سوف يكتسب لهب موقد الغاز نفس اللون إذا قمت برشه بملح الطعام العادي. عندما يحترق النحاس، سيكون اللهب أخضر. أعتقد أنك لاحظت أنه عند ارتداء خاتم أو سلسلة مصنوعة من النحاس العادي غير المطلي بمركب وقائي لفترة طويلة، يصبح الجلد أخضر اللون. ويحدث نفس الشيء أثناء عملية الاحتراق. إذا كان محتوى النحاس مرتفعًا، فسيظهر ضوء أخضر ساطع جدًا، مطابق تقريبًا للون الأبيض. يمكن ملاحظة ذلك إذا قمت برش نشارة النحاس على موقد الغاز.
تم إجراء العديد من التجارب باستخدام موقد غاز عادي ومعادن مختلفة. وبهذه الطريقة تم تحديد تكوينهم. عليك أن تأخذ المعدن بالملاقط وتضعه في اللهب. يمكن أن يشير اللون الذي تأخذه النار إلى الشوائب المختلفة الموجودة في العنصر. ويشير اللهب الأخضر وظلاله إلى وجود النحاس والباريوم والموليبدينوم والأنتيمون والفوسفور. ينتج البورون اللون الأزرق والأخضر. السيلينيوم يعطي اللهب صبغة زرقاء. يتم تلوين اللهب باللون الأحمر في وجود السترونتيوم والليثيوم والكالسيوم والبنفسجي - البوتاسيوم. يتم إنتاج اللون الأصفر البرتقالي عند احتراق الصوديوم.
يتم إجراء دراسات على المعادن لتحديد تركيبها باستخدام موقد بنسن. لون لهبها موحد وعديم اللون، ولا يتعارض مع سير التجربة. اخترع بنسن الموقد في منتصف القرن التاسع عشر.
لقد توصل إلى طريقة تسمح للمرء بتحديد تركيبة المادة من خلال ظل اللهب. وقد حاول العلماء من قبله إجراء تجارب مماثلة، لكنهم لم يكن لديهم موقد بنسن، الذي لم يتعارض لهب عديم اللون مع سير التجربة. وقد وضع عناصر مختلفة على سلك من البلاتين في نار الموقد، حيث أنه عند إضافة هذا المعدن، لا يتلون اللهب. للوهلة الأولى، تبدو الطريقة جيدة، ويمكن الاستغناء عن التحليل الكيميائي الذي يتطلب عمالة مكثفة. كل ما تحتاجه هو إحضار العنصر إلى النار ومعرفة ما يتكون منه. لكن المواد في شكلها النقي نادرًا ما توجد في الطبيعة. وهي تحتوي عادة على كميات كبيرة من الشوائب المختلفة التي تغير لون اللهب.
حاول بنسن إبراز الألوان والظلال باستخدام طرق مختلفة. على سبيل المثال، استخدام الزجاج الملون. لنفترض أنك إذا نظرت من خلال الزجاج الأزرق، فلن ترى اللون الأصفر الذي تتحول إليه النار عند حرق أملاح الصوديوم الأكثر شيوعًا. ثم يصبح من الممكن تمييز الظل الأرجواني أو القرمزي للعنصر المطلوب. ولكن حتى مثل هذه الحيل أدت إلى التحديد الصحيح لتركيب المعدن المعقد في حالات نادرة جدًا. هذه التكنولوجيا لا يمكن أن تحقق المزيد.
في الوقت الحاضر، يتم استخدام مثل هذه الشعلة فقط للحام.
النيران تأتي بألوان مختلفة. انظر إلى المدفأة. تتراقص النيران باللون الأصفر والبرتقالي والأحمر والأبيض والأزرق على جذوع الأشجار. يعتمد لونه على درجة حرارة الاحتراق والمواد القابلة للاحتراق. لتصور ذلك، تخيل دوامة الموقد الكهربائي. إذا تم إيقاف تشغيل البلاط، فإن المنعطفات الحلزونية تكون باردة وسوداء. لنفترض أنك قررت تسخين الحساء وتشغيل الموقد. في البداية يتحول اللولب إلى اللون الأحمر الداكن. كلما ارتفعت درجة الحرارة، كلما كان اللون الأحمر للدوامة أكثر إشراقا. عندما يصل البلاط إلى درجة الحرارة القصوى، يتحول لون الملف إلى اللون البرتقالي والأحمر.
وبطبيعة الحال، لا يحترق اللولب. أنت لا ترى اللهب. انها ساخنة حقا. إذا قمت بتسخينه أكثر، سوف يتغير اللون. أولاً، سوف يتحول لون اللولب إلى اللون الأصفر، ثم إلى الأبيض، وعندما يسخن أكثر، سوف ينبعث منه توهج أزرق.

ويحدث شيء مماثل مع النار. لنأخذ شمعة كمثال. المناطق المختلفة من لهب الشمعة لها درجات حرارة مختلفة. النار تحتاج إلى الأكسجين. إذا قمت بتغطية شمعة بوعاء زجاجي، فسوف تنطفئ النار. المنطقة الوسطى من لهب الشمعة المجاورة للفتيل تستهلك كمية قليلة من الأكسجين فتبدو داكنة. تتلقى المناطق العلوية والجانبية من اللهب كمية أكبر من الأكسجين، وبالتالي تكون هذه المناطق أكثر سطوعًا. عندما يتحرك اللهب عبر الفتيل، يذوب الشمع ويتشقق وينقسم إلى جزيئات كربون صغيرة. (يتكون الفحم أيضًا من الكربون.) يتم حمل هذه الجسيمات إلى أعلى بواسطة اللهب وتحترق. فهي ساخنة للغاية وتتوهج مثل دوامة البلاط الخاص بك. لكن جزيئات الكربون تكون أكثر سخونة بكثير من لفائف البلاط الأكثر سخونة (درجة حرارة احتراق الكربون تبلغ حوالي 1400 درجة مئوية). لذلك، توهجهم أصفر. وبالقرب من الفتيل المحترق، يكون اللهب أكثر سخونة ويتوهج باللون الأزرق.
لهيب الموقد أو النار يكون في الغالب متنوعًا في المظهر.يحترق الخشب عند درجة حرارة أقل من فتيل الشمعة، لذا فإن اللون الأساسي للنار هو البرتقالي وليس الأصفر. تتمتع بعض جزيئات الكربون الموجودة في لهب النار بدرجة حرارة عالية إلى حد ما. هناك عدد قليل منهم، لكنهم يضيفون صبغة صفراء إلى اللهب. جزيئات الكربون الساخنة المبردة هي السخام الذي يستقر على المداخن. درجة حرارة احتراق الخشب أقل من درجة حرارة احتراق الشمعة. عند تسخين الكالسيوم والصوديوم والنحاس إلى درجات حرارة عالية، يتوهج بألوان مختلفة. يتم إضافتها إلى مسحوق الصواريخ لتلوين أضواء الألعاب النارية في الأعياد.
لون اللهب والتركيب الكيميائي
قد يختلف لون اللهب اعتمادًا على الشوائب الكيميائية الموجودة في جذوع الأشجار أو غيرها من المواد القابلة للاشتعال. قد يحتوي اللهب، على سبيل المثال، على شوائب الصوديوم.

حتى في العصور القديمة، حاول العلماء والكيميائيون فهم المواد المحترقة في النار، اعتمادًا على لون النار.
- الصوديوم هو أحد مكونات ملح الطعام. عندما يتم تسخين الصوديوم، فإنه يتحول إلى اللون الأصفر الساطع.
- قد يتم إطلاق الكالسيوم في النار. نعلم جميعًا أن الحليب يحتوي على الكثير من الكالسيوم. إنه معدن. يتحول الكالسيوم الساخن إلى اللون الأحمر الفاتح.
- إذا احترق الفسفور في النار، يتحول اللهب إلى اللون الأخضر. وكل هذه العناصر إما موجودة في الخشب أو تدخل النار مع مواد أخرى.
- يمتلك كل شخص تقريبًا في المنزل مواقد غاز أو سخانات مياه، لون لهبها أزرق. ويرجع ذلك إلى الكربون القابل للاحتراق وأول أكسيد الكربون الذي يعطي هذا الظل.

مزج ألوان اللهب، مثل مزج ألوان قوس قزح، يمكن أن ينتج اللون الأبيض، ولهذا السبب تظهر مناطق بيضاء في لهيب النار أو المدفأة.
درجة حرارة اللهب عند احتراق بعض المواد:
كيفية الحصول على لون لهب متساوي؟
لدراسة المعادن وتحديد تركيبها يتم استخدامها موقد بنسن، مما يعطي لونًا لهبًا عديم اللون ولا يتعارض مع مسار التجربة التي اخترعها بنسن في منتصف القرن التاسع عشر.

كان بنسن من أشد المعجبين بعنصر النار وغالبًا ما كان يتلاعب باللهب. وكانت هوايته نفخ الزجاج. من خلال نفخ تصميمات وآليات مختلفة من الزجاج، لم يتمكن بنسن من ملاحظة الألم. كانت هناك أوقات بدأت فيها أصابعه المتصلبة بالتدخين من الزجاج الساخن الناعم، لكنه لم ينتبه لذلك. إذا كان الألم قد تجاوز بالفعل عتبة الحساسية، فقد أنقذ نفسه بطريقته الخاصة - فقد ضغط على شحمة الأذن بأصابعه بقوة، وقاطع ألمًا بآخر.
كان هو مؤسس طريقة تحديد تركيبة المادة حسب لون اللهب. وبالطبع حاول العلماء قبله إجراء مثل هذه التجارب، لكن لم يكن لديهم موقد بنسن لهب عديم اللون لا يتعارض مع التجربة. قام بإدخال عناصر مختلفة على سلك البلاتين في لهب الموقد، حيث أن البلاتين لا يؤثر على لون اللهب ولا يلونه.
يبدو أن الطريقة جيدة، وليست هناك حاجة لتحليل كيميائي معقد، قم بإحضار العنصر إلى اللهب وسترى تركيبته على الفور. ولكن لم يكن هناك. ونادرا ما توجد مواد في الطبيعة في شكلها النقي، فهي عادة ما تحتوي على مجموعة كبيرة من الشوائب المختلفة التي تغير لونها.
جرب بنسن طرقًا مختلفة لعزل الألوان وظلالها. على سبيل المثال، حاولت أن أنظر من خلال الزجاج الملون. لنفترض أن الزجاج الأزرق يطفئ اللون الأصفر الذي تنتجه أملاح الصوديوم الأكثر شيوعًا، ويمكن للمرء أن يميز اللون القرمزي أو الأرجواني للعنصر الأصلي. ولكن حتى بمساعدة هذه الحيل، كان من الممكن تحديد تكوين المعدن المعقد مرة واحدة فقط في مائة.
هذا مثير للاهتمام!ونظراً لخاصية الذرات والجزيئات بإصدار ضوء بلون معين، فقد تم تطوير طريقة لتحديد تركيب المواد وهي ما يسمى التحليل الطيفي. يقوم العلماء بدراسة الطيف الذي تنبعثه المادة، على سبيل المثال، عند احتراقها، ومقارنتها بأطياف العناصر المعروفة، وبالتالي تحديد تركيبها.

حرق الألمنيوم
احتراق الألمنيوم في الهواء
على عكس المغنيسيوم، لا تشتعل جزيئات الألومنيوم المنفردة عند تسخينها في الهواء أو بخار الماء إلى 2100 كلفن. تم استخدام حرق جزيئات المغنيسيوم لإشعال الألومنيوم. تم وضع الأخير على سطح عنصر التسخين، وتم وضع جزيئات الألومنيوم على طرف الإبرة على مسافة 10-4 م فوق الأول.
عندما تشتعل جزيئات الألومنيوم، يحدث الاشتعال في مرحلة البخار، وتزداد شدة منطقة التوهج التي تظهر حول الجسيم ببطء. يتميز الاحتراق الثابت بوجود منطقة متوهجة لا يتغير حجمها حتى يحترق المعدن بالكامل تقريبًا. نسبة أحجام منطقة التوهج والجسيمات هي 1.6-1.9. في منطقة التوهج، تتشكل قطرات أكسيد صغيرة، والتي تندمج عند الاصطدام.
البقايا بعد احتراق الجسيم عبارة عن قشرة مجوفة لا تحتوي على أي معدن بداخلها. يتم التعبير عن اعتماد وقت احتراق الجسيم على حجمه من خلال الصيغة (الاحتراق المتماثل).
احتراق الألمنيوم في بخار الماء
يحدث اشتعال الألومنيوم في بخار الماء بشكل غير متجانس. يساهم الهيدروجين المنطلق أثناء التفاعل في تدمير طبقة الأكسيد؛ وفي هذه الحالة يتم رش أكسيد الألومنيوم السائل (أو هيدروكسيد) على شكل قطرات يصل قطرها إلى 10-15 ميكرون. يتكرر هذا التدمير لقشرة الأكسيد بشكل دوري. يشير هذا إلى أن جزءًا كبيرًا من المعدن يحترق على سطح الجسيم.
في بداية الاحتراق، تكون النسبة rsv / ص 0 يساوي 1.6-1.7. أثناء عملية الاحتراق، يقل حجم الجسيمات، وتزداد نسبة gs/o إلى 2.0-3.0. معدل احتراق جزيء الألومنيوم في بخار الماء أكبر بحوالي 5 مرات من الهواء.
احتراق سبائك الألومنيوم والمغنيسيوم
احتراق سبائك الألومنيوم والمغنيسيوم في الهواء
إن اشتعال جزيئات سبائك الألومنيوم والمغنيسيوم ذات التركيب المتغير في الهواء، ومخاليط الأكسجين والأرجون، وبخار الماء وثاني أكسيد الكربون، كقاعدة عامة، يشبه اشتعال جزيئات المغنيسيوم. يسبق بداية الاشتعال تفاعلات مؤكسدة تحدث على السطح.
يختلف احتراق سبائك الألومنيوم والمغنيسيوم اختلافًا كبيرًا عن احتراق كل من الألومنيوم والمغنيسيوم ويعتمد بشدة على نسبة المكونات الموجودة في السبائك وعلى معلمات البيئة المؤكسدة. الميزة الأكثر أهمية لاحتراق جزيئات السبائك هي العملية المكونة من مرحلتين (الشكل 2.6). في المرحلة الأولى، يتم إحاطة الجسيم بمجموعة من المشاعل، مما يشكل منطقة تألق غير موحدة لنواتج التفاعل. وبمقارنة طبيعة وحجم المنطقة المضيئة المحيطة بجسيم السبيكة أثناء المرحلة الأولى من الاحتراق مع طبيعة وحجم المنطقة المضيئة حول جسيم الماغنيسيوم المحترق (انظر الشكل 2.4)، يمكننا أن نستنتج أنه في هذه المرحلة، يكون المغنيسيوم بشكل رئيسي يحترق من الجسيمات.

أرز. 2.6. احتراق جسيم سبيكة بنسبة 30% Al + 70% Mg عند الضغط الجوي العادي في خليط يحتوي على 15% O من حيث الحجم 2و 85% ع:
1, 2 – نضوب المغنيسيوم. 3-6 – احتراق الألومنيوم
من سمات المرحلة الأولى من احتراق السبائك ثبات حجم الجسيمات ومنطقة اللهب. وهذا يعني أن القطرة السائلة من السبيكة موجودة داخل غلاف أكسيد صلب. ويهيمن أكسيد المغنيسيوم على فيلم الأكسيد. من خلال عيوب الفيلم، يتدفق المغنيسيوم، ويحترق في لهب انتشار مرحلة البخار.
وفي نهاية المرحلة الأولى يزداد حدوث التفاعلات غير المتجانسة، كما يتضح من ظهور مناطق ذات توهج ساطع على سطح الجسيم. تساهم الحرارة المنبعثة أثناء التفاعلات غير المتجانسة في تسخين الجسيم إلى درجة انصهار الأكسيد وبداية المرحلة الثانية من الاحتراق.
في المرحلة الثانية من الاحتراق، يُحاط الجسيم بمنطقة متوهجة موحدة وأكثر سطوعًا، والتي تتناقص مع احتراق المعدن. يشير تجانس وكروية منطقة اللهب إلى أن طبقة الأكسيد الموجودة على سطح الجسيم منصهرة. يتم ضمان انتشار المعدن عبر الفيلم من خلال مقاومة الانتشار المنخفضة للأكسيد السائل. يتجاوز حجم منطقة اللهب حجم الجسيمات بشكل كبير، مما يدل على احتراق المعدن في مرحلة البخار. إن مقارنة طبيعة المرحلة الثانية من الاحتراق مع النمط المعروف لاحتراق الألمنيوم تشير إلى تشابه كبير، فمن المرجح أن الألمنيوم يحترق في هذه المرحلة من العملية. ومع احتراقه، يتناقص حجم اللهب، وبالتالي انخفاض قطرة الاحتراق. يتوهج الجسيم المحترق لفترة طويلة.
يعد تغيير حجم منطقة توهج الجسيمات المحترقة وفقًا للآلية الموصوفة أمرًا معقدًا (الشكل 2.7). بعد اشتعال القيمة صشارع. / ص 0 بسرعة (في -0.1 مللي ثانية) يصل إلى القيمة القصوى (القسم أب). وعلاوة على ذلك، خلال الوقت الرئيسي للمرحلة الأولى من الاحتراق، النسبة صشارع/ ص 0 يظل ثابتًا (القسم بي في). عندما ينتهي احتراق المغنيسيوم، صالسيرة الذاتية/ صيتم تقليل 0 إلى الحد الأدنى (نقطة ز)،ثم مع بداية احتراق الألمنيوم تزداد (القسم gd). وأخيرا، ولكن كما يحترق الألومنيوم صشارع. / ص 0 يتناقص رتابة (القسم دي) إلى قيمة نهائية تتوافق مع حجم الأكسيد المتكون.

أرز. 2.7.:
1 – سبيكة 30% آل + 70% ملغم، هواء؛ 2 – سبيكة 30% A1 + 70% مغنيسيوم، خليط 15% O2 + 85% Ar؛ 3 - سبيكة 50% A1 + 50% ملغم، هواء
تعتمد آلية ومعلمات عملية احتراق سبائك الألومنيوم والمغنيسيوم بشكل كبير على تركيبة السبيكة. مع انخفاض محتوى المغنيسيوم في السبيكة، يقل حجم منطقة التوهج أثناء المرحلة الأولى من الاحتراق ومدة هذه المرحلة. عندما يكون محتوى المغنيسيوم في السبيكة أقل من 30%، تظل العملية عبارة عن عملية من مرحلتين، ولكنها تصبح متقطعة. في نهاية المرحلة الأولى، يتم تقليل منطقة التوهج إلى حجم الجسيم نفسه، وتتوقف عملية الاحتراق، ولا يحترق الألومنيوم إلا بعد إعادة إشعال الجسيم. الجسيمات التي لا تشتعل مرة أخرى هي عبارة عن قذائف أكسيد مجوفة مسامية تحتوي بداخلها على قطرات من الألومنيوم غير المحترق.
يتم التعبير عن اعتماد وقت احتراق الجزيئات على قطرها الأولي من خلال الصيغ التجريبية التالية:

احتراق سبائك الألومنيوم والمغنيسيوم في مخاليط الأكسجين مع الأرجون وفي بخار الماء وثاني أكسيد الكربون.
طبيعة احتراق جزيئات سبائك الألومنيوم والمغنيسيوم في مخاليط الأكسجين والأرجون هي نفسها كما في الهواء. مع انخفاض محتوى الأكسجين، ينخفض \u200b\u200bحجم منطقة التوهج أثناء نضوب المغنيسيوم بشكل ملحوظ. يتم التعبير عن اعتماد وقت احتراق جزيئات سبيكة 50% Al + 50% Mg على حجم الجسيم ومحتوى الأكسجين في الخليط بالنسبة المئوية للحجم بواسطة الصيغة
يختلف احتراق السبائك في بخار الماء اختلافًا كبيرًا (الشكل 2.8). يتم تدمير طبقة الأكسيد التي تكونت خلال المرحلة الأولى بواسطة الهيدروجين، ويأخذ الجسيم مظهر المرجان. يشتعل الألومنيوم المتبقي في المرجان خلال 1-10 مللي ثانية فقط بعد نهاية المرحلة الأولى. يعد هذا التقطع في العملية أمرًا نموذجيًا بالنسبة للسبائك من أي تركيبة.

أرز. 2.8. احتراق جزيئات سبائك الألومنيوم والمغنيسيوم (50:50) كروية(أ) وخطأ(ب) يتشكل في بخار الماء عند الضغط الجوي العادي:
1 – الجسيم الأولي. 2 – الجسيمات قبل الاشتعال. 3 – نضوب المغنيسيوم. 4 - احتراق الألمنيوم. 5- المرجان المتكون بعد الجسيم
عندما تحترق سبائك الألومنيوم والمغنيسيوم في ثاني أكسيد الكربون، يحترق المغنيسيوم فقط من الجسيم، وبعد ذلك تتوقف عملية الاحتراق.
احتراق سبائك الألومنيوم والمغنيسيوم في لهب ذو درجة حرارة عالية
لدراسة عملية احتراق الجزيئات المعدنية عند درجات حرارة عالية، تم حرق قرص مضغوط من خليط بيركلورات الأمونيوم والهكسامين، بدرجات حرارة احتراق محسوبة تبلغ 2500 و2700 و3100 كلفن، تحت جسيم مثبت على طرف إبرة.
يحدث احتراق جزيئات سبائك الألومنيوم والمغنيسيوم في ظل هذه الظروف، كقاعدة عامة، مع انفجار. يعد وجود الانفجار أمرًا نموذجيًا بالنسبة للجزيئات من جميع التركيبات. ونتيجة للانفجار، يتم تشكيل منطقة التلألؤ كبيرة، وهي علامة على غلبة الاحتراق في مرحلة البخار. صور لجسيم محترق في بداية الاحتراق (الشكل 2.9، أ) تبين أن التفاعلات غير المتجانسة تحدث على كامل سطح غلاف الأكسيد. بسبب حرارة التفاعلات غير المتجانسة، يحدث تبخر سريع للمعدن (الشكل 2.9، ب)، تعزيز تمزق غلاف الأكسيد وتناثر القطرة غير المتبخرة (الشكل 2.9، الخامس).

أرز. 2.9. احتراق 95% من جزيئات السبائكمع 5% Mg في لهب مؤكسد (درجة حرارة 2700 كلفن):
أ– المرحلة الأولية للاحتراق. ب- الاحتراق الثابت؛ الخامس- ينفصل
وفقًا لـ B. G. Lrabey، وS. E. Salibekov، وYu. V. Leninsky، فإن سحق جزيئات سبائك الألومنيوم والمغنيسيوم يحدث بسبب اختلاف كبير جدًا في درجات حرارة غليان المغنيسيوم والألومنيوم، ونتيجة لذلك يغلي المغنيسيوم عندما يغلي الجسيم. وجوده في منطقة ذات درجة حرارة عالية يكون قابلاً للانفجار ويؤدي إلى سحق ما تبقى من الألومنيوم. درجة حرارة 2500 كلفن كافية بالفعل لحدوث احتراق متفجر، وهو أمر طبيعي تمامًا، لأن درجة الحرارة هذه تتجاوز نقطة الغليان لكلا المكونين.
- أرابي بي جي، ساليبيكوف إس إي، ليفينسكي يو في.بعض خصائص اشتعال واحتراق الغبار المعدني // تعدين المساحيق. 1964. رقم 3. ص 109-118.
لصياغة قوانين العمليات الجارية، يمكننا أن نقتصر على النظر في الكاتيونات واستبعاد الأنيونات، لأنها نفسها لا تشارك في التفاعل. (ومع ذلك، فإن معدل الترسيب يتأثر بنوع الأنيونات.) إذا افترضنا، للتبسيط، أن كلا من المعادن المتحررة والمذابة ثنائية التكافؤ، فيمكننا أن نكتب:
أنا 1 + أنا 2 2+ => أنا 1 2+ + أنا 2
علاوة على ذلك، بالنسبة للتجربة الأولى Me 1 = Fe، Me 2 = Cu. إذن، تتكون العملية من تبادل الشحنات (الإلكترونات) بين ذرات وأيونات كلا المعدنين. إذا نظرنا بشكل منفصل (كتفاعلات وسيطة) في انحلال الحديد أو ترسيب النحاس، نحصل على:
الحديد => الحديد 2+ + 2ه -
سو 2+ + 2е - => سو
الآن فكر في الحالة التي يكون فيها المعدن مغمورًا في الماء أو في محلول ملحي، حيث يكون تبادل الكاتيون مستحيلًا بسبب موقعه في سلسلة الإجهاد. وعلى الرغم من ذلك، يميل المعدن إلى الذوبان على شكل أيون. وفي هذه الحالة تتخلى ذرة المعدن عن إلكترونين (إذا كان المعدن ثنائي التكافؤ)، ويصبح سطح المعدن المغمور في المحلول مشحوناً بشحنة سالبة بالنسبة للمحلول، وتتكون طبقة كهربائية مزدوجة عند السطح البيني. ويمنع هذا الاختلاف المحتمل حدوث المزيد من انحلال المعدن، بحيث تتوقف العملية قريبًا. إذا تم غمر معدنين مختلفين في محلول، فسوف يشحن كلاهما، لكن المعدن الأقل نشاطًا سيكون أضعف إلى حد ما، نظرًا لأن ذراته أقل عرضة لفقد الإلكترونات. دعونا نربط كلا المعدنين بموصل. بسبب فرق الجهد، سيتدفق تدفق الإلكترونات من المعدن الأكثر نشاطًا إلى المعدن الأقل نشاطًا، مما يشكل القطب الموجب للعنصر. تحدث عملية يدخل فيها المعدن الأكثر نشاطًا إلى المحلول، ويتم إطلاق الكاتيونات من المحلول على المعدن الأكثر نقاءً.
جوهر الخلية الجلفانية
دعونا الآن نوضح من خلال عدة تجارب المنطق المجرد إلى حد ما المذكور أعلاه (والذي يمثل، علاوة على ذلك، تبسيطًا فادحًا).
أولاً، املأ كوبًا سعة 250 مل إلى المنتصف بمحلول 10٪ من حمض الكبريتيك واغمر فيه قطعًا ليست صغيرة جدًا من الزنك والنحاس. نحن نلحم أو نثبت الأسلاك النحاسية على كلا القطبين الكهربائيين، ويجب ألا تلمس نهاياتها المحلول.
وطالما أن طرفي السلك غير متصلين ببعضهما البعض، فسوف نلاحظ ذوبان الزنك الذي يصاحبه إطلاق الهيدروجين. الزنك، كما يلي من سلسلة الجهد، أكثر نشاطًا من الهيدروجين، لذلك يمكن للمعدن أن يحل محل الهيدروجين من الحالة الأيونية. تتشكل طبقة كهربائية مزدوجة على كلا المعدنين. أسهل طريقة لاكتشاف فرق الجهد بين الأقطاب الكهربائية هي باستخدام الفولتميتر. مباشرة بعد توصيل الجهاز بالدائرة، سيشير السهم إلى حوالي 1 فولت، ولكن بعد ذلك سينخفض الجهد بسرعة. إذا قمت بتوصيل مصباح كهربائي صغير يستهلك 1 فولت بالعنصر، فسوف يضيء - في البداية بقوة كافية، ثم يصبح التوهج ضعيفًا.
بناءً على قطبية أطراف الجهاز، يمكننا أن نستنتج أن قطب النحاس هو القطب الموجب. ويمكن إثبات ذلك بدون جهاز من خلال النظر في الكيمياء الكهربائية للعملية. لنعد محلولًا مشبعًا من ملح الطعام في كوب صغير أو أنبوب اختبار، ونضيف حوالي 0.5 مل من محلول الكحول لمؤشر الفينول فثالين ونغمر كلا القطبين الكهربائيين المغلقين بالسلك في المحلول. سيتم ملاحظة لون محمر باهت بالقرب من القطب السالب، والذي ينتج عن تكوين هيدروكسيد الصوديوم عند الكاثود.
وفي تجارب أخرى، يمكن وضع أزواج مختلفة من المعادن في خلية وتحديد الجهد الناتج. على سبيل المثال، سيعطي المغنيسيوم والفضة فرقًا محتملًا كبيرًا بشكل خاص نظرًا للمسافة الكبيرة بينهما وبين سلسلة من الفولتية، بينما سيعطي الزنك والحديد، على العكس من ذلك، فرقًا صغيرًا جدًا، أقل من عُشر فولت. باستخدام الألومنيوم، لن نتلقى عمليا أي تيار بسبب التخميل.
كل هذه العناصر، أو، كما يقول علماء الكيمياء الكهربائية، الدوائر، لها عيب أنه عند قياس التيار، ينخفض الجهد عبرها بسرعة كبيرة. ولذلك، يقوم الكيميائيون الكهربيون دائمًا بقياس القيمة الحقيقية للجهد في حالة عدم تنشيطه باستخدام هذه الطريقة تعويض الجهدأي مقارنته بجهد مصدر تيار آخر.
دعونا نفكر في العمليات التي تتم في عنصر النحاس والزنك بمزيد من التفصيل. عند الكاثود، يدخل الزنك إلى المحلول وفق المعادلة التالية:
الزنك => الزنك 2+ + 2هـ -
يتم تفريغ أيونات الهيدروجين من حامض الكبريتيك عند أنود النحاس. يقومون بتوصيل الإلكترونات القادمة عبر السلك من كاثود الزنك ونتيجة لذلك تتشكل فقاعات الهيدروجين:
2Н + + 2е - => ح 2
وبعد فترة قصيرة من الزمن، سيتم تغطية النحاس بطبقة رقيقة من فقاعات الهيدروجين. في هذه الحالة، سيتحول قطب النحاس إلى قطب هيدروجيني، وسيقل فرق الجهد. هذه العملية تسمى الاستقطابالقطب. يمكن إزالة استقطاب قطب النحاس عن طريق إضافة القليل من محلول ثاني كرومات البوتاسيوم إلى الخلية بعد انخفاض الجهد. بعد ذلك، سيزداد الجهد مرة أخرى، حيث سيؤدي ثنائي كرومات البوتاسيوم إلى أكسدة الهيدروجين إلى الماء. يعمل ثنائي كرومات البوتاسيوم في هذه الحالة على النحو التالي: مزيل الاستقطاب
في الممارسة العملية، يتم استخدام الدوائر الكلفانية التي تكون أقطابها الكهربائية غير مستقطبة، أو الدوائر التي يمكن إزالة استقطابها عن طريق إضافة مزيلات الاستقطاب.
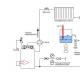
وكمثال على عنصر غير قابل للاستقطاب، فكر في عنصر دانيال، والذي كان يستخدم غالبًا في الماضي كمصدر حالي. وهو أيضًا عنصر من النحاس والزنك، لكن كلا المعدنين مغموران في محاليل مختلفة. يتم وضع قطب الزنك في خلية طينية مسامية مملوءة بحمض الكبريتيك المخفف (حوالي 20٪). والخلية الطينية معلقة في كوب كبير يحتوي على محلول مركز من كبريتات النحاس، وفي الأسفل توجد طبقة من بلورات كبريتات النحاس. القطب الثاني في هذا الوعاء عبارة عن أسطوانة مصنوعة من صفائح النحاس.
يمكن صنع هذا العنصر من وعاء زجاجي، وخلية طينية متاحة تجاريًا (في الحالات القصوى، نستخدم إناء للزهور، ونغلق الفتحة الموجودة في الأسفل) وقطبين كهربائيين بحجم مناسب.
أثناء تشغيل الخلية، يذوب الزنك لتكوين كبريتات الزنك، ويتم إطلاق النحاس المعدني عند قطب النحاس. لكن في الوقت نفسه، القطب النحاسي غير مستقطب وينتج العنصر جهدًا يبلغ حوالي 1 فولت. في الواقع، من الناحية النظرية، الجهد عند الأطراف هو 1.10 فولت، ولكن عند جمع التيار نقيس قيمة أقل قليلاً بسبب التيار الكهربائي. مقاومة الخلية.
إذا لم نقم بإزالة التيار من العنصر، فنحن بحاجة إلى إزالة قطب الزنك من محلول حمض الكبريتيك، لأنه بخلاف ذلك سوف يذوب لتكوين الهيدروجين.
يظهر في الشكل رسم تخطيطي لخلية بسيطة لا تتطلب قسمًا مساميًا. يقع قطب الزنك في الجزء العلوي من الجرة الزجاجية، ويقع القطب النحاسي بالقرب من الجزء السفلي. تمتلئ الخلية بأكملها بمحلول مشبع من ملح الطعام. ضع حفنة من بلورات كبريتات النحاس في قاع الجرة. سوف يمتزج محلول كبريتات النحاس المركز الناتج مع محلول ملح الطعام ببطء شديد. لذلك، عندما تعمل الخلية، سيتم إطلاق النحاس على قطب النحاس، وسوف يذوب الزنك على شكل كبريتات أو كلوريد في الجزء العلوي من الخلية.
في الوقت الحاضر يتم استخدامها بشكل حصري تقريبًا للبطاريات. العناصر الجافة، والتي هي أكثر ملاءمة للاستخدام. سلفهم هو عنصر Leclanche. الأقطاب الكهربائية عبارة عن أسطوانة زنك وقضيب كربون. المنحل بالكهرباء عبارة عن عجينة تتكون أساسًا من كلوريد الأمونيوم. يذوب الزنك في العجينة، وينطلق الهيدروجين على الفحم. لتجنب الاستقطاب، يتم غمس قضيب الكربون في كيس من الكتان يحتوي على خليط من مسحوق الفحم والبيرولوسيت. يزيد مسحوق الكربون من سطح القطب، ويعمل البيرولوسيت كمزيل للاستقطاب، مما يؤدي إلى أكسدة الهيدروجين ببطء. صحيح أن قدرة البيرولوسيت على إزالة الاستقطاب أضعف من قدرة ثنائي كرومات البوتاسيوم المذكورة سابقًا. لذلك، عندما يتم تلقي التيار في العناصر الجافة، ينخفض الجهد بسرعة، فهي "تتعب" بسبب الاستقطاب. فقط بعد مرور بعض الوقت تحدث أكسدة الهيدروجين باستخدام البيرولوسيت. وهكذا فإن العناصر "تستقر" إذا لم يمر تيار لبعض الوقت. دعونا نتحقق من ذلك باستخدام بطارية المصباح الذي نوصل به المصباح الكهربائي. نقوم بتوصيل الفولتميتر بالتوازي مع المصباح، أي مباشرة إلى المحطات الطرفية. في البداية، سيكون الجهد حوالي 4.5 فولت. (في أغلب الأحيان، تحتوي هذه البطاريات على ثلاث خلايا متصلة على التوالي، كل منها بجهد نظري يبلغ 1.48 فولت.) بعد مرور بعض الوقت، سينخفض الجهد وسيصبح توهج المصباح الكهربائي يضعف. بناءً على قراءات الفولتميتر، يمكننا الحكم على المدة التي تحتاجها البطارية للراحة.
وتحتل العناصر المتجددة المعروفة باسم البطاريات مكانًا خاصًا. إنها تخضع لتفاعلات عكسية ويمكن إعادة شحنها بعد تفريغ الخلية عن طريق الاتصال بمصدر تيار مستمر خارجي.
حاليًا، تعد بطاريات الرصاص الحمضية هي الأكثر شيوعًا؛ المنحل بالكهرباء الموجود فيها هو حمض الكبريتيك المخفف، حيث يتم غمر لوحتين من الرصاص. القطب الموجب مطلي ببيروكسيد الرصاص PbO 2 (الاسم الحديث هو ثاني أكسيد الرصاص)، والقطب السالب هو الرصاص المعدني. يبلغ الجهد عند الأطراف حوالي 2.1 فولت. عند التفريغ، تتشكل كبريتات الرصاص على كلا الصفيحتين، والتي تتحول مرة أخرى إلى الرصاص المعدني وبيروكسيد الرصاص عند الشحن.