Brinner aluminium i öppen eld? Hur får man en jämn flamfärg? Förbränning av aluminium-magnesiumlegeringar i luft
Det är inte svårt att gissa att nyansen på en låga bestäms av de kemikalier som brinner i den, om exponering för hög temperatur frigör enskilda atomer av de brännbara ämnena och färgar elden. För att bestämma effekten av ämnen på eldens färg utfördes olika experiment, som vi kommer att diskutera nedan.
Sedan urminnes tider har alkemister och vetenskapsmän försökt ta reda på vilka ämnen som brinner, beroende på färgen som lågan får.
Lågorna från gasvattenberedare och spisar, tillgängliga i alla hus och lägenheter, har en blå nyans. När den bränns produceras denna nyans av kol, kolmonoxid. Den gulorange färgen på lågan i en eld som tänds i skogen, eller på tändstickor, beror på det höga innehållet av natriumsalter i naturligt trä. Till stor del tack vare detta - rött. Lågan på en gasspisbrännare får samma färg om du strö den med vanligt bordssalt. När koppar brinner blir lågan grön. Jag tror att du har märkt att när du bär en ring eller kedja av vanlig koppar som inte är belagd med en skyddande förening under lång tid så blir huden grön. Samma sak händer under förbränningsprocessen. Om kopparhalten är hög uppstår ett mycket starkt grönt ljus, nästan identiskt med vitt. Detta kan ses om du strör kopparspån på en gasolbrännare.
Många experiment har utförts med en vanlig gasbrännare och olika mineraler. På så sätt bestämdes deras sammansättning. Du måste ta mineralet med pincett och placera det i lågan. Färgen som elden antar kan indikera de olika föroreningarna som finns i elementet. En grön låga och dess nyanser indikerar närvaron av koppar, barium, molybden, antimon och fosfor. Bor ger en blågrön färg. Selen ger lågan en blå nyans. Lågan är färgad röd i närvaro av strontium, litium och kalcium, och violett - kalium. Den gul-orange färgen skapas när natrium brinner.
Studier av mineraler för att bestämma deras sammansättning utförs med en bunsenbrännare. Färgen på dess låga är jämn och färglös, den stör inte experimentets gång. Bunsen uppfann brännaren i mitten av 1800-talet.
Han kom på en metod som gör att man kan bestämma sammansättningen av ett ämne genom lågans skugga. Forskare hade försökt utföra liknande experiment före honom, men de hade ingen bunsenbrännare, vars färglösa låga inte störde experimentets framsteg. Han placerade olika element på en platinatråd i brännarelden, eftersom när denna metall läggs till blir lågan inte färgad. Vid en första anblick verkar metoden bra, arbetskrävande kemisk analys kan undvaras. Du behöver bara ta med elementet till elden och se vad det består av. Men ämnen i sin rena form kan hittas ytterst sällan i naturen. De innehåller vanligtvis stora mängder olika föroreningar som ändrar färgen på lågan.
Bunsen försökte framhäva färger och nyanser med olika metoder. Till exempel att använda färgat glas. Låt oss säga att om du tittar genom blått glas kommer du inte att se den gula färgen som elden vänder när du bränner de vanligaste natriumsalterna. Då blir den lila eller crimson nyansen av det önskade elementet urskiljbar. Men även sådana knep ledde till korrekt bestämning av sammansättningen av ett komplext mineral i mycket sällsynta fall. Denna teknik kunde inte uppnå mer.
Numera används en sådan ficklampa endast för lödning.
Lågor finns i olika färger. Titta in i den öppna spisen. Gula, orange, röda, vita och blå lågor dansar på stockarna. Dess färg beror på förbränningstemperaturen och det brännbara materialet. För att visualisera detta, föreställ dig spiralen av en elektrisk spis. Om brickan är avstängd är spiralvarven kalla och svarta. Låt oss säga att du bestämmer dig för att värma upp soppan och slå på spisen. Till en början blir spiralen mörkröd. Ju högre temperaturen stiger, desto ljusare är spiralens röda färg. När plattan når sin maximala temperatur blir spolen orangeröd.
Naturligtvis brinner inte spiralen. Du ser inte lågan. Hon är bara riktigt het. Om du värmer den ytterligare kommer färgen att ändras. Först kommer färgen på spiralen att bli gul, sedan vit, och när den värms upp ännu mer kommer ett blått sken att utgå från den.

Något liknande händer med eld. Låt oss ta ett ljus som exempel. Olika områden av en ljus låga har olika temperaturer. Eld behöver syre. Om du täcker ett ljus med en glasburk slocknar elden. Det centrala området av ljusflamman intill veken förbrukar lite syre och ser mörk ut. Lågans övre och sidoområden får mer syre, så dessa områden är ljusare. När lågan rör sig genom veken smälter vaxet och krackelerar och bryts ner i små kolpartiklar. (Kol består också av kol.) Dessa partiklar förs uppåt av lågan och brinner. De är väldigt varma och lyser som spiralen på din kakel. Men kolpartiklarna är mycket varmare än spolen på den hetaste plattan (kolförbränningstemperaturen är ungefär 1 400 grader Celsius). Därför är deras glöd gul. Nära den brinnande veken är lågan ännu hetare och lyser blått.
Lågorna i en öppen spis eller eld är mestadels brokiga till utseendet. Trä brinner vid en lägre temperatur än en ljusveke, så eldens grundfärg är orange snarare än gul. Vissa kolpartiklar i en eldslåga har en ganska hög temperatur. Det finns få av dem, men de ger en gulaktig nyans till lågan. Kylda partiklar av hett kol är sot som lägger sig på skorstenarna. Brinntemperaturen för ved är lägre än brinntemperaturen för ett ljus. Kalcium, natrium och koppar lyser i olika färger när de värms upp till höga temperaturer. De läggs till raketpulver för att färga ljusen från semesterfyrverkerier.
Flamfärg och kemisk sammansättning
Lågans färg kan variera beroende på de kemiska föroreningarna som finns i stockarna eller andra brandfarliga ämnen. Lågan kan innehålla till exempel natriumföroreningar.

Även i antiken försökte vetenskapsmän och alkemister förstå vilken typ av ämnen som brann i eld, beroende på eldens färg.
- Natrium är en komponent i bordssalt. När natrium värms upp blir det ljust gult.
- Kalcium kan släppas ut i elden. Vi vet alla att mjölk innehåller mycket kalcium. Det är metall. Varmt kalcium blir klarrött.
- Om fosfor brinner i en eld blir lågan grönaktig. Alla dessa element finns antingen i trä eller går in i elden med andra ämnen.
- Nästan alla hemma har gasspisar eller varmvattenberedare, vars lågor är blå färgade. Detta på grund av brännbart kol, kolmonoxid, som ger denna nyans.

Att blanda färgerna på en låga, som att blanda färgerna på en regnbåge, kan producera vitt, vilket är anledningen till att vita områden är synliga i lågorna från en eld eller öppen spis.
Flamtemperatur vid förbränning av vissa ämnen:
Hur får man en jämn flamfärg?
För att studera mineraler och bestämma deras sammansättning används det bunsenbrännare, vilket ger en jämn, färglös lågfärg som inte stör experimentets gång, uppfann av Bunsen i mitten av 1800-talet.

Bunsen var en ivrig fan av eldelementet och pysslade ofta med lågor. Hans hobby var glasblåsning. Genom att blåsa olika listiga mönster och mekanismer ur glas kunde Bunsen inte märka smärtan. Det fanns tillfällen då hans förhårda fingrar började ryka från det varma, fortfarande mjuka glaset, men han brydde sig inte om det. Om smärtan redan hade gått över tröskeln för känslighet, räddade han sig själv med sin egen metod - han tryckte hårsnibben hårt med fingrarna och avbröt en smärta med en annan.
Det var han som var grundaren av metoden för att bestämma sammansättningen av ett ämne genom flammans färg. Naturligtvis, före honom, försökte forskare utföra sådana experiment, men de hade inte en Bunsen-brännare med en färglös låga som inte stör experimentet. Han introducerade olika element på platinatråd i brännarlågan, eftersom platina inte påverkar lågans färg och inte färgar den.
Det verkar som om metoden är bra, det finns inget behov av komplicerad kemisk analys; ta elementet till lågan och dess sammansättning är omedelbart synlig. Men det fanns inte där. Mycket sällan finns ämnen i naturen i sin rena form, de innehåller vanligtvis ett stort utbud av olika föroreningar som ändrar färg.
Bunsen provade olika metoder för att isolera färger och deras nyanser. Jag försökte till exempel titta genom färgat glas. Säg, blått glas släcker den gula färgen som produceras av de vanligaste natriumsalterna, och man kunde urskilja en röd eller lila nyans av det inhemska elementet. Men även med hjälp av dessa knep var det möjligt att bestämma sammansättningen av ett komplext mineral endast en gång på hundra.
Det här är intressant! På grund av atomers och molekylers egenskap att avge ljus av en viss färg utvecklades en metod för att bestämma ämnens sammansättning, som kallas spektral analys. Forskare studerar det spektrum som ett ämne avger, till exempel när det brinner, jämför det med spektra av kända grundämnen och bestämmer på så sätt dess sammansättning.

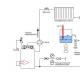
Brinnande aluminium
Aluminium brinner i luften
Till skillnad från magnesium antänds inte enstaka aluminiumpartiklar när de värms upp i luft eller vattenånga till 2100 K. Brinnande magnesiumpartiklar användes för att antända aluminium. De senare placerades på ytan av värmeelementet, och aluminiumpartiklarna placerades på spetsen av nålen på ett avstånd av 10-4 m ovanför den förra.
När aluminiumpartiklar antänds sker antändning i ångfasen, och intensiteten i glödzonen som uppstår runt partikeln ökar långsamt. Stationär förbränning kännetecknas av att det finns en glödzon, som inte ändrar sin storlek förrän metallen är nästan helt utbränd. Förhållandet mellan storlekarna på glödzonen och partikeln är 1,6-1,9. I glödzonen bildas små oxiddroppar som smälter samman vid kollision.
Återstoden efter förbränning av partikeln är ett ihåligt skal som inte innehåller någon metall inuti. Beroendet av en partikels brinntid på dess storlek uttrycks med formeln (symmetrisk förbränning).
Förbränning av aluminium i vattenånga
Antändning av aluminium i vattenånga sker heterogent. Vätet som frigörs under reaktionen bidrar till förstörelsen av oxidfilmen; i detta fall sprutas flytande aluminiumoxid (eller hydroxid) i form av droppar med en diameter på upp till 10-15 mikron. Sådan förstörelse av oxidskalet upprepas med jämna mellanrum. Detta tyder på att en betydande del av metallen brinner på partikelns yta.
I början av förbränningen är förhållandet rsv /r 0 är lika med 1,6-1,7. Under förbränningsprocessen minskar partikelstorleken och gs/?o-förhållandet ökar till 2,0-3,0. Förbränningshastigheten för en aluminiumpartikel i vattenånga är nästan 5 gånger högre än i luft.
Förbränning av aluminium-magnesiumlegeringar
Förbränning av aluminium-magnesiumlegeringar i luft
Antändningen av partiklar av aluminium-magnesiumlegeringar av variabel sammansättning i luft, syre-argonblandningar, vattenånga och koldioxid fortskrider som regel på samma sätt som antändning av magnesiumpartiklar. Uppkomsten av antändning föregås av oxidativa reaktioner som sker på ytan.
Förbränning av aluminium-magnesiumlegeringar skiljer sig väsentligt från förbränning av både aluminium och magnesium och beror starkt på förhållandet mellan komponenterna i legeringen och på parametrarna för den oxiderande miljön. Den viktigaste egenskapen för förbränning av legeringspartiklar är tvåstegsprocessen (Fig. 2.6). I det första steget omges partikeln av en uppsättning ficklampor, som bildar en ojämn zon av luminescens för reaktionsprodukterna. Genom att jämföra naturen och storleken på den ljuszon som omger legeringspartikeln under det första steget av förbränning med arten och storleken på den lysande zonen runt den brinnande magnesiumpartikeln (se fig. 2.4), kan vi dra slutsatsen att i detta skede, huvudsakligen magnesium brinner ut ur partikeln.

Ris. 2.6. Förbränning av en legeringspartikel av 30 % Al + 70 % Mg vid normalt atmosfärstryck i en blandning innehållande 15 % O i volym 2och 85 % Ar:
1, 2 – magnesium utbrändhet; 3-6 – utbränd aluminium
En egenskap hos det första steget av legeringsförbränning är konstantheten hos partikelstorlek och flamzon. Detta betyder att vätskedroppen av legeringen finns i ett fast oxidskal. Oxidfilmen domineras av magnesiumoxid. Genom filmdefekter rinner magnesium ut och brinner i en diffusionslåga i ångfas.
I slutet av det första steget ökar förekomsten av heterogena reaktioner, vilket framgår av uppkomsten av foci av ljus luminescens på partikelytan. Värmen som frigörs under heterogena reaktioner bidrar till att värma partikeln till oxidens smältpunkt och början av det andra förbränningssteget.
I det andra steget av förbränningen omges partikeln av en enhetlig, ljusare glödzon, som minskar när metallen brinner ut. Flamzonens homogenitet och sfäricitet indikerar att oxidfilmen på ytan av partikeln är smält. Diffusion av metallen genom filmen säkerställs av den flytande oxidens låga diffusionsmotstånd. Flamzonens storlek överstiger avsevärt partikelstorleken, vilket indikerar förbränning av metallen i ångfasen. Jämförelse av arten av det andra förbränningssteget med det kända mönstret av aluminiumförbränning indikerar en stor likhet, det är troligt att aluminium brinner i detta skede av processen. När den brinner ut minskar lågans storlek och följaktligen den brinnande droppen. Den brända partikeln lyser länge.
Att ändra storleken på glödzonen för en partikel som brinner i enlighet med den beskrivna mekanismen är komplex (fig. 2.7). Efter tändning värdet r St. /r 0 snabbt (i -0,1 ms) når maxvärdet (sektion ab). Vidare, under huvudtiden av det första förbränningssteget, förhållandet r St/ r 0 förblir konstant (sektion bv). När magnesiumutbränningen tar slut, r CV/ r 0 reduceras till ett minimum (punkt G), och sedan, med början av aluminiumförbränning, ökar den (avsnitt gd). Äntligen, men som aluminium brinner ut r St. /r 0 minskar monotont (sektion de) till ett slutvärde som motsvarar storleken på den bildade oxiden.

Ris. 2.7.:
1 – legering 30 % Al + 70 % Mg, luft; 2 – legering 30 % A1 + 70 % Mg, blandning 15 % O2 + 85 % Ar; 3 – legering 50% A1 + 50% Mg, luft
Mekanismen och parametrarna för förbränningsprocessen av aluminium-magnesiumlegeringar beror avsevärt på legeringens sammansättning. Med en minskning av magnesiumhalten i legeringen minskar storleken på glödzonen under det första steget av förbränning och varaktigheten av detta steg. När magnesiumhalten i legeringen är mindre än 30 % förblir processen en tvåstegsprocess, men blir intermittent. I slutet av det första steget reduceras glödzonen till storleken på själva partikeln, förbränningsprocessen stoppas och aluminium brinner ut först efter att partikeln har antänts igen. De partiklar som inte antänds igen är ihåliga, porösa oxidskal som innehåller droppar av oförbränt aluminium inuti.
Beroendet av partiklars brinntid på deras initiala diameter uttrycks med följande empiriska formler:

Förbränning av aluminium-magnesiumlegeringar i blandningar av syre med argon, i vattenånga och i koldioxid.
Naturen för förbränning av partiklar av aluminium-magnesiumlegeringar i syre-argonblandningar är densamma som i luft. Med en minskning av syrehalten minskar storleken på glödzonen under magnesiumutbränning märkbart. Beroendet av förbränningstiden för partiklar av legeringen 50 % Al + 50 % Mg på partikelstorleken och syrehalten i blandningen i volymprocent uttrycks med formeln
Förbränningen av legeringar i vattenånga skiljer sig väsentligt (fig. 2.8). Oxidfilmen som bildas under det första steget förstörs av väte och partikeln ser ut som korall. Aluminiumet som finns kvar i korallen antänds endast 1-10 ms efter slutet av det första steget. Sådan intermittens av processen är typisk för legeringar av vilken sammansättning som helst.

Ris. 2.8. Förbränning av partiklar av aluminium-magnesiumlegering (50:50) sfäriska(A) och fel(b) bildas i vattenånga vid normalt atmosfärstryck:
1 - initial partikel; 2 – partikel före antändning; 3 - magnesiumutbrändhet; 4 - aluminiumutbrändhet; 5 – korall bildad efter partikeln
När aluminium-magnesium-legeringar brinner i koldioxid, brinner bara magnesium ut ur partikeln, varefter förbränningsprocessen stannar.
Förbränning av aluminium-magnesiumlegeringar i en låga med hög temperatur
För att studera förbränningsprocessen av metallpartiklar vid höga temperaturer brändes en pressad tablett av blandningar av ammoniumperklorat och hexamin, med beräknade förbränningstemperaturer på 2500, 2700 och 3100 K, under en partikel monterad på spetsen av en nål.
Förbränning av partiklar av aluminium-magnesiumlegeringar under dessa förhållanden sker som regel med en explosion. Närvaron av en explosion är typisk för partiklar av alla sammansättningar. Som ett resultat av explosionen bildas en betydande luminescenszon, vilket är ett tecken på dominansen av ångfasförbränning. Fotografier av en brinnande partikel i början av förbränningen (Fig. 2.9, A) visar att heterogena reaktioner sker över hela ytan av oxidskalet. På grund av värmen från heterogena reaktioner sker snabb avdunstning av metallen (Fig. 2.9, b), vilket främjar bristning av oxidskalet och stänk av den oförångade droppen (Fig. 2.9, V).

Ris. 2.9. Förbränning av 95% Al-legeringspartikel med 5 % Mg i oxiderande låga (temperatur 2700 K):
A– Förbränningsstadiet; b– stationär förbränning; V- separera
Enligt B. G. Lrabey, S. E. Salibekov och Yu. V. Leninsky orsakas krossning av partiklar av aluminium-magnesiumlegeringar av en mycket stor skillnad i koktemperaturen för magnesium och aluminium, vilket resulterar i kokningen av magnesium när partikeln befinner sig i en högtemperaturzon är explosiv och leder till krossning av kvarvarande aluminium. En temperatur på 2500 K är redan tillräcklig för att explosiv förbränning ska uppstå, vilket är ganska naturligt, eftersom denna temperatur överstiger kokpunkten för båda komponenterna.
- Arabey B. G., Salibekov S. E., Levinsky Yu. V. Vissa egenskaper för antändning och förbränning av metalldamm // Pulvermetallurgi. 1964. Nr 3. S. 109-118.
För att formulera lagarna för de pågående processerna kan vi begränsa oss till att överväga katjoner och utesluta anjoner, eftersom de själva inte deltar i reaktionen. (Men avsättningshastigheten påverkas av typen av anjoner.) Om vi för enkelhetens skull antar att både de frigjorda och lösta metallerna är tvåvärda, så kan vi skriva:
Jag 1 + Jag 2 2+ => Jag 1 2+ + Jag 2
Dessutom, för det första experimentet Me 1 = Fe, Me 2 = Cu. Så, processen består av utbyte av laddningar (elektroner) mellan atomer och joner av båda metallerna. Om vi separat betraktar (som mellanreaktioner) upplösningen av järn eller utfällningen av koppar, får vi:
Fe => Fe 2+ + 2е -
Сu 2+ + 2е - => Сu
Tänk nu på fallet när en metall är nedsänkt i vatten eller i en saltlösning, med en katjon vars utbyte är omöjligt på grund av dess position i spänningsserien. Trots detta tenderar metallen att gå i lösning i form av en jon. I det här fallet ger metallatomen upp två elektroner (om metallen är tvåvärd), ytan på metallen som är nedsänkt i lösningen blir negativt laddad i förhållande till lösningen och ett dubbelt elektriskt skikt bildas vid gränsytan. Denna potentialskillnad förhindrar ytterligare upplösning av metallen, så att processen snart stannar. Om två olika metaller är nedsänkta i en lösning kommer de båda att ladda, men den mindre aktiva kommer att vara något svagare, på grund av att dess atomer är mindre benägna att förlora elektroner. Låt oss ansluta båda metallerna med en ledare. På grund av potentialskillnaden kommer ett flöde av elektroner att flöda från den mer aktiva metallen till den mindre aktiva, som bildar elementets positiva pol. En process inträffar där den mer aktiva metallen går i lösning, och katjoner från lösningen frigörs på den ädlare metallen.
Kärnan i en galvanisk cell
Låt oss nu med flera experiment illustrera det något abstrakta resonemanget ovan (som dessutom representerar en grov förenkling).
Fyll först en 250 ml bägare till mitten med en 10% lösning av svavelsyra och doppa inte för små bitar av zink och koppar i den. Vi löder eller nitar koppartråd till båda elektroderna, vars ändar inte bör röra lösningen.
Så länge ändarna av tråden inte är anslutna till varandra, kommer vi att observera upplösningen av zink, som åtföljs av frigörandet av väte. Zink, som följer från spänningsserien, är mer aktivt än väte, så metallen kan tränga undan väte från jontillståndet. Ett elektriskt dubbelskikt bildas på båda metallerna. Det enklaste sättet att upptäcka potentialskillnaden mellan elektroderna är med en voltmeter. Omedelbart efter anslutning av enheten till kretsen kommer pilen att indikera cirka 1 V, men då kommer spänningen snabbt att sjunka. Om du kopplar in en liten glödlampa som förbrukar 1 V till elementet kommer den att lysa - till en början ganska starkt och sedan blir glöden svag.
Baserat på polariteten hos enhetens terminaler kan vi dra slutsatsen att kopparelektroden är den positiva polen. Detta kan bevisas utan en anordning genom att beakta processens elektrokemi. Låt oss förbereda en mättad lösning av bordssalt i en liten bägare eller provrör, tillsätt cirka 0,5 ml av en alkohollösning av fenolftaleinindikatorn och doppa ner båda elektroderna stängda med tråd i lösningen. En svagt rödaktig färg kommer att observeras nära den negativa polen, vilket orsakas av bildandet av natriumhydroxid vid katoden.
I andra experiment kan man placera olika metallpar i en cell och bestämma den resulterande spänningen. Till exempel kommer magnesium och silver att ge en särskilt stor potentialskillnad på grund av det betydande avståndet mellan dem och en serie spänningar, medan zink och järn tvärtom ger en mycket liten, mindre än en tiondels volt. Genom att använda aluminium får vi praktiskt taget ingen ström på grund av passivering.
Alla dessa element, eller, som elektrokemisterna säger, kretsar, har nackdelen att spänningen över dem sjunker mycket snabbt när man mäter ström. Därför mäter elektrokemister alltid det verkliga värdet av spänningen i ett strömlöst tillstånd med hjälp av metoden spänningskompensation, det vill säga att jämföra den med spänningen hos en annan strömkälla.
Låt oss överväga processerna i koppar-zinkelementet lite mer i detalj. Vid katoden går zink i lösning enligt följande ekvation:
Zn => Zn 2+ + 2e -
Vätejoner av svavelsyra släpps ut vid kopparanoden. De fäster elektroner som kommer genom tråden från zinkkatoden och som ett resultat bildas vätebubblor:
2Н + + 2е - => Í 2
Efter en kort tid kommer kopparn att täckas med ett tunt lager av vätebubblor. I det här fallet kommer kopparelektroden att förvandlas till en väte, och potentialskillnaden kommer att minska. Denna process kallas polarisering elektrod. Polariseringen av kopparelektroden kan elimineras genom att tillsätta lite kaliumdikromatlösning till cellen efter spänningsfallet. Efter detta kommer spänningen att öka igen, eftersom kaliumdikromat kommer att oxidera väte till vatten. Kaliumbikromat fungerar i detta fall som depolarisator
I praktiken används galvaniska kretsar vars elektroder inte är polariserade, eller kretsar vars polarisering kan elimineras genom att lägga till depolarisatorer.
Som ett exempel på ett icke-polariserbart element, betrakta Daniel-elementet, som ofta användes förr som en aktuell källa. Detta är också ett koppar-zinkelement, men båda metallerna är nedsänkta i olika lösningar. Zinkelektroden placeras i en porös lercell fylld med utspädd (ca 20 %) svavelsyra. Lercellen är suspenderad i ett stort glas innehållande en koncentrerad lösning av kopparsulfat, och i botten finns ett lager av kopparsulfatkristaller. Den andra elektroden i detta kärl är en cylinder gjord av kopparplåt.
Detta element kan tillverkas av en glasburk, en kommersiellt tillgänglig lercell (i extrema fall använder vi en blomkruka, stänger hålet i botten) och två elektroder av lämplig storlek.
Under drift av cellen löses zink och bildar zinksulfat och metallisk koppar frigörs vid kopparelektroden. Men samtidigt är kopparelektroden inte polariserad och elementet producerar en spänning på cirka 1 V. Faktiskt, teoretiskt, är spänningen vid terminalerna 1,10 V, men när vi samlar ström mäter vi ett något lägre värde på grund av den elektriska cellens motstånd.
Om vi inte tar bort strömmen från elementet måste vi ta bort zinkelektroden från svavelsyralösningen, för annars kommer den att lösas upp och bilda väte.
Ett diagram över en enkel cell som inte kräver en porös skiljevägg visas i figuren. Zinkelektroden är placerad på toppen av glasburken, och kopparelektroden är placerad nära botten. Hela cellen är fylld med en mättad lösning av bordssalt. Placera en handfull kopparsulfatkristaller i botten av burken. Den resulterande koncentrerade kopparsulfatlösningen kommer att blandas med bordssaltlösningen mycket långsamt. När cellen är i drift kommer därför koppar att frigöras på kopparelektroden och zink kommer att lösas upp i form av sulfat eller klorid i den övre delen av cellen.
Numera används de nästan uteslutande för batterier. torra element, som är bekvämare att använda. Deras förfader är Leclanche-elementet. Elektroderna är en zinkcylinder och en kolstav. Elektrolyten är en pasta som huvudsakligen består av ammoniumklorid. Zink löser sig i pastan och väte frigörs på kolet. För att undvika polarisering doppas kolstaven i en linnepåse innehållande en blandning av kolpulver och pyrolusit. Kolpulvret ökar elektrodytan, och pyrolusiten fungerar som en depolarisator och oxiderar långsamt vätet. Det är sant att pyrolusitens depolariserande förmåga är svagare än det tidigare nämnda kaliumbikromatet. Därför, när ström tas emot i torra element, sjunker spänningen snabbt, de "trötts" på grund av polarisering. Först efter en tid sker oxidation av väte med pyrolusit. Således "vilar" elementen om ingen ström passerar under en tid. Låt oss kolla detta på ett ficklampsbatteri som vi ansluter en glödlampa till. Vi ansluter en voltmeter parallellt med lampan, det vill säga direkt till terminalerna. Till en början kommer spänningen att vara cirka 4,5 V. (Oftast har sådana batterier tre celler kopplade i serie, var och en med en teoretisk spänning på 1,48 V.) Efter en tid kommer spänningen att sjunka och glödlampans glöd kommer försvagas. Baserat på voltmeteravläsningarna kan vi bedöma hur länge batteriet behöver vila.
En speciell plats upptas av regenererande element som kallas batterier. De genomgår reversibla reaktioner och kan laddas efter att cellen har laddats ur genom att anslutas till en extern likströmskälla.
För närvarande är blybatterier de vanligaste; Elektrolyten i dem är utspädd svavelsyra, i vilken två blyplattor är nedsänkta. Den positiva elektroden är belagd med blyperoxid PbO 2 (modernt namn är blydioxid), den negativa elektroden är metalliskt bly. Spänningen vid plintarna är cirka 2,1 V. Vid urladdning bildas blysulfat på båda plattorna, som återigen blir till metalliskt bly och blyperoxid vid laddning.