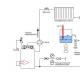
Ar aliuminis perdega atviroje ugnyje? Kaip išgauti tolygią liepsnos spalvą? Aliuminio-magnio lydinių deginimas ore
Nesunku atspėti, kad liepsnos atspalvį lemia joje degančios cheminės medžiagos, tuo atveju, kai veikiant aukštai temperatūrai išsiskiria atskiri degių medžiagų atomai, nuspalvinantys ugnį. Norint nustatyti medžiagų poveikį ugnies spalvai, buvo atlikti įvairūs eksperimentai, kuriuos aptarsime toliau.
Nuo seniausių laikų alchemikai ir mokslininkai bandė išsiaiškinti, kokios medžiagos dega, priklausomai nuo liepsnos spalvos.
Visuose namuose ir butuose esanti geizerių ir krosnių liepsna turi mėlyną atspalvį. Toks atspalvis degimo metu suteikia anglies, anglies monoksido. Miške auginamos ugnies liepsnos ar buitinių degtukų geltonai oranžinę spalvą lemia didelis natrio druskų kiekis natūralioje medienoje. Daugiausia dėl to – raudona. Dujinės viryklės degiklio liepsna įgaus tokią pat spalvą, jei ją pabarstysite įprasta valgomąja druska. Deginant varį, liepsna bus žalia. Manau, pastebėjote, kad ilgai nešiojant žiedą ar grandinėlę iš paprasto vario, nepadengtą apsauginiu junginiu, oda pažaliuoja. Tas pats vyksta degimo proceso metu. Jei vario kiekis yra didelis, yra labai ryškiai žalia ugnis, beveik identiška baltai. Tai galima pastebėti, jei ant dujų degiklio pilamos vario drožlės.
Buvo atlikta daug eksperimentų su įprastu dujų degikliu ir įvairiais mineralais. Taigi buvo nustatyta jų sudėtis. Mineralą reikia paimti pincetu ir įdėti į liepsną. Ugnies įgaunama spalva gali rodyti įvairias elemente esančias priemaišas. Žalios spalvos liepsna ir jos atspalviai rodo, kad yra vario, bario, molibdeno, stibio, fosforo. Boras suteikia mėlynai žalią spalvą. Selenas suteikia liepsnai mėlyną atspalvį. Liepsna pasidaro raudona, kai yra stroncio, ličio ir kalcio, violetinėje – kalio. Geltonai oranžinė spalva gaunama degant natriui.
Mineralų tyrimai, siekiant nustatyti jų sudėtį, atliekami naudojant Bunsen degiklį. Jo liepsnos spalva yra lygi ir bespalvė, ji netrukdo eksperimento eigai. Bunsenas išrado degiklį XIX amžiaus viduryje.
Jis sugalvojo metodą, leidžiantį nustatyti medžiagos sudėtį pagal liepsnos atspalvį. Mokslininkai bandė atlikti panašius eksperimentus prieš jį, tačiau jie neturėjo Bunseno degiklio, kurio bespalvė liepsna netrukdė eksperimentui. Į degiklio ugnį jis padėjo įvairius elementus ant platinos vielos, nes pridėjus šio metalo liepsna nenuspalvina. Iš pirmo žvilgsnio metodas atrodo geras; galima apsieiti be sudėtingos cheminės analizės. Pakanka tik atnešti elementą prie ugnies ir pamatyti, iš ko jis susideda. Tačiau grynos medžiagos gamtoje galima rasti labai retai. Paprastai juose yra daug įvairių priemaišų, kurios keičia liepsnos spalvą.
Bunsenas bandė atskirti spalvas ir atspalvius įvairiais metodais. Pavyzdžiui, naudojant spalvotus akinius. Pavyzdžiui, pažvelgę pro mėlyną stiklą, deginant dažniausiai pasitaikančias natrio druskas, nepamatysite geltonos spalvos, kuria nudažyta ugnis. Tada pastebimas norimo elemento alyvinis arba tamsiai raudonas atspalvis. Tačiau net ir tokie triukai leido labai retais atvejais teisingai nustatyti sudėtingo mineralo sudėtį. Daugiau nei ši technologija negalėjo pasiekti.
Šiais laikais toks degiklis naudojamas tik litavimui.
Liepsna būna įvairių spalvų. Pažiūrėk į židinį. Ant rąstų šoka geltonos, oranžinės, raudonos, baltos ir mėlynos liepsnos. Jo spalva priklauso nuo degimo temperatūros ir nuo degios medžiagos. Norėdami tai įsivaizduoti, įsivaizduokite elektrinės viryklės spiralę. Jei plytelė išjungta, spiralės ritės yra šaltos ir juodos. Tarkime, nuspręsite pašildyti sriubą ir įjungti viryklę. Iš pradžių spiralė tampa tamsiai raudona. Kuo aukščiau pakyla temperatūra, tuo ryškesnė spiralės raudona spalva. Kai plytelė pasiekia maksimalią temperatūrą, spiralė tampa oranžinės raudonos spalvos.
Natūralu, kad spiralė nedega. Tu nematai liepsnos. Ji tiesiog labai karšta. Jei kaitinsite toliau, pasikeis ir spalva. Iš pradžių spiralės spalva taps geltona, vėliau balta, o kai dar labiau įkais, nuo jos sklis mėlynas švytėjimas.

Kažkas panašaus atsitinka su ugnimi. Kaip pavyzdį paimkime žvakę. Skirtingos žvakės liepsnos dalys turi skirtingą temperatūrą. Ugniai reikia deguonies. Jei žvakė uždengta stikliniu indeliu, ugnis užges. Centrinė žvakės liepsnos sritis, esanti šalia dagčio, sunaudoja mažai deguonies ir atrodo tamsi. Liepsnos viršus ir šonai gauna daugiau deguonies, todėl šios sritys yra šviesesnės. Kai liepsna plinta per dagtį, vaškas tirpsta ir traška, suskaidydamas į mažas anglies daleles. (Anglis taip pat pagaminta iš anglies.) Šios dalelės liepsnos neša aukštyn ir išdega. Jie labai karšti ir švyti kaip jūsų plytelių spiralė. Tačiau anglies dalelės yra daug karštesnės nei karščiausios plytelės spiralė (anglies degimo temperatūra yra apie 1400 laipsnių Celsijaus). Todėl jų švytėjimas yra geltonos spalvos. Prie degančio dagčio liepsna dar karštesnė ir švyti mėlynai.
Židinio ar laužo liepsna dažniausiai būna marga. Mediena dega žemesnėje temperatūroje nei žvakės dagtis, todėl pagrindinė ugnies spalva yra oranžinė, o ne geltona. Kai kurios anglies dalelės ugnies liepsnoje turi gana aukštą temperatūrą. Jų nėra daug, bet jos prideda liepsnai gelsvą atspalvį. Atvėsusios įkaitusios anglies dalelės yra suodžiai, kurie nusėda ant kaminų. Medienos degimo temperatūra yra žemesnė už žvakės degimo temperatūrą. Kalcis, natris ir varis, pakaitinti iki aukštos temperatūros, šviečia skirtingomis spalvomis. Jų dedama į raketų paraką, kad nuspalvintų šventinių fejerverkų šviesas.
Liepsnos spalva ir cheminė sudėtis
Liepsnos spalva gali keistis priklausomai nuo rąstuose esančių cheminių priemaišų ar kitų degiųjų medžiagų. Liepsnoje gali būti, pavyzdžiui, natrio mišinio.

Net senovėje mokslininkai ir alchemikai bandė suprasti, kokios medžiagos dega ugnyje, priklausomai nuo ugnies spalvos.
- Natris yra valgomosios druskos sudedamoji dalis. Kaitinamas natris, jis tampa ryškiai geltonas.
- Kalcis gali patekti į ugnį. Visi žinome, kad piene yra daug kalcio. Tai metalas. Karštas kalcis pasidaro ryškiai raudonas.
- Jei ugnyje sudegs fosforas, liepsna pasidarys žalsva. Visi šie elementai yra medyje arba patenka į ugnį su kitomis medžiagomis.
- Beveik visuose namuose yra dujinės viryklės arba vandens šildytuvai, kurių liepsna yra mėlyna. Taip yra dėl degiosios anglies, anglies monoksido, kuris suteikia tokį atspalvį.

Maišant liepsnos spalvas, kaip ir vaivorykštės spalvas, galima gauti baltos spalvos, todėl židinio ar židinio liepsnose matomi balti ploteliai.
Liepsnos temperatūra degant tam tikroms medžiagoms:
Kaip išgauti tolygią liepsnos spalvą?
Ištirti mineralus ir nustatyti jų sudėtį, Bunseno degiklis, kuri suteikia tolygią, bespalvę liepsnos spalvą, kuri netrukdo eksperimento eigai, kurią XIX amžiaus viduryje išrado Bunsenas.

Bunsenas buvo aistringas ugnies stichijos gerbėjas, dažnai jaudindamasis su liepsna. Jo aistra buvo stiklo pūtimas. Iš stiklo pūsdamas įvairius gudrius dizainus ir mechanizmus, Bunsenas negalėjo pastebėti skausmo. Pasitaikė, kad jo sukietėję pirštai pradėjo rūkyti nuo karšto dar minkšto stiklo, tačiau jis į tai nekreipė dėmesio. Jei skausmas jau peržengė jautrumo slenkstį, tai jis išsigelbėjo savo metodu – pirštais stipriai spaudė ausies spenelį, vieną skausmą nutraukdamas kitu.
Būtent jis buvo medžiagos sudėties nustatymo pagal liepsnos spalvą metodo įkūrėjas. Žinoma, dar prieš jį mokslininkai bandė atlikti tokius eksperimentus, tačiau jie neturėjo Bunseno degiklio su bespalve liepsna, kuri netrukdytų eksperimentui. Į degiklio liepsną jis įvedė įvairius elementus ant platinos vielos, nes platina neturi įtakos liepsnos spalvai ir jos nespalvina.
Atrodytų, metodas geras, nereikia sudėtingos cheminės analizės, elementą nukėliau į liepsną - ir jo sudėtis iškart matosi. Bet jo ten nebuvo. Labai retai medžiagos gamtoje randamos gryna forma, dažniausiai jose yra daug įvairių priemaišų, kurios keičia spalvą.
Bunsenas išbandė įvairius spalvų ir jų atspalvių išskyrimo būdus. Pavyzdžiui, jis bandė žiūrėti pro spalvotus akinius. Pavyzdžiui, mėlynas stiklas užgesina geltoną spalvą, kurią suteikia labiausiai paplitusios natrio druskos, ir galima išskirti tamsiai raudoną arba purpurinį vietinio elemento atspalvį. Tačiau net ir naudojant šiuos triukus sudėtingo mineralo sudėtį buvo galima nustatyti tik kartą iš šimto.
Tai įdomu! Dėl atomų ir molekulių savybės skleisti tam tikros spalvos šviesą buvo sukurtas medžiagų sudėties nustatymo metodas, kuris vadinamas. spektrinė analizė. Mokslininkai tiria spektrą, kurį medžiaga skleidžia, pavyzdžiui, degimo metu, lygina jį su žinomų elementų spektrais ir taip nustato jos sudėtį.

Degantis aliuminis
Aliuminio deginimas ore
Skirtingai nuo magnio, pavienės aliuminio dalelės neužsidega, kai kaitinamos ore arba vandens garuose iki 2100 K. Aliuminiui uždegti buvo naudojamos degančios magnio dalelės. Pastarieji buvo dedami ant kaitinimo elemento paviršiaus, o aliuminio dalelės – ant adatos galo 10–4 m atstumu virš pirmojo.
Aliuminio dalelės užsiliepsnoja jo užsidegimo metu garų fazėje, o aplink dalelę atsirandančios švytėjimo zonos intensyvumas didėja lėtai. Stacionariam degimui būdinga švytėjimo zona, kurios dydis nesikeičia tol, kol metalas beveik visiškai nesudegs. Švytėjimo zonos ir dalelės dydžių santykis yra 1,6-1,9. Švytėjimo zonoje susidaro maži oksido lašeliai, kurie susidūrus susilieja.
Likutis po dalelės degimo yra tuščiaviduris apvalkalas, kurio viduje nėra metalo. Dalelės degimo laiko priklausomybė nuo jos dydžio išreiškiama formule (degimas simetriškas).
Aliuminio deginimas vandens garuose
Aliuminio užsidegimas vandens garuose vyksta nevienalyčiai. Reakcijos metu išsiskiriantis vandenilis prisideda prie oksido plėvelės sunaikinimo; o skystas aliuminio oksidas (arba hidroksidas) purškiamas iki 10-15 mikronų skersmens lašelių pavidalu. Toks oksido apvalkalo sunaikinimas periodiškai kartojamas. Tai rodo, kad didelė metalo dalis dega dalelės paviršiuje.
Degimo pradžioje santykis r /r 0 yra lygus 1,6-1,7. Degimo metu dalelių dydis mažėja, o santykis gsw/?o padidėja iki 2,0-3,0. Aliuminio dalelės degimo greitis vandens garuose yra beveik 5 kartus didesnis nei ore.
Aliuminio-magnio lydinių deginimas
Aliuminio-magnio lydinių deginimas ore
Įvairios sudėties aliuminio-magnio lydinių dalelių užsidegimas ore, deguonies-argono mišiniuose, vandens garuose ir anglies dioksidu paprastai vyksta panašiai kaip magnio dalelių užsidegimas. Prieš užsiliepsnojimą paviršiuje vyksta oksidacinės reakcijos.
Aliuminio ir magnio lydinių degimas labai skiriasi nuo aliuminio ir magnio degimo ir stipriai priklauso nuo lydinyje esančių komponentų santykio ir nuo oksiduojančios terpės parametrų. Svarbiausia lydinio dalelių degimo ypatybė – dviejų pakopų procesas (2.6 pav.). Pirmajame etape dalelė yra apsupta degiklių, kurie sudaro nehomogenišką reakcijos produktų švytėjimo zoną. Lyginant lydinio dalelę supančios švytėjimo zonos pobūdį ir dydį per pirmąjį degimo etapą su švytėjimo zonos aplink degančią magnio dalelę pobūdžiu ir dydžiu (žr. 2.4 pav.), galime daryti išvadą, kad šioje stadijoje tai daugiausia magnio, kuris išdega iš dalelės.

Ryžiai. 2.6. Lydinio dalelės 30 % A1 + 70 % Mg deginimas esant normaliam atmosferos slėgiui mišinyje, kuriame yra 15 % tūrio O 2ir 85 % Ar:
1, 2 – magnio perdegimas; 3-6 – aliuminio perdegimas
Pirmojo lydinio degimo etapo ypatybė yra dalelių dydžio ir liepsnos zonos pastovumas. Tai reiškia, kad skystas lydinio lašelis yra uždarytas kieto oksido apvalkale. Oksido plėvelėje vyrauja magnio oksidas. Magnis išteka per plėvelės defektus ir dega garų fazės difuzinėje liepsnoje.
Pirmojo etapo pabaigoje nevienalyčių reakcijų eiga didėja, tai liudija dalelės paviršiuje atsiradę ryškios liuminescencijos centrai. Šiluma, išsiskirianti heterogeninių reakcijų metu, prisideda prie dalelės kaitinimo iki oksido lydymosi temperatūros ir antrojo degimo etapo pradžios.
Antrame degimo etape dalelę supa vienalytė, ryškesnė švytėjimo zona, kuri mažėja, kai metalas perdega. Liepsnos zonos homogeniškumas ir sferiškumas rodo, kad dalelės paviršiuje esanti oksido plėvelė išsilydo. Metalo difuziją per plėvelę užtikrina mažas skysto oksido atsparumas difuzijai. Liepsnos zonos dydis žymiai viršija dalelės dydį, o tai rodo metalo degimą garų fazėje. Palyginus antrojo degimo etapo pobūdį su žinomu aliuminio degimo modeliu, galima matyti didelį panašumą, tikriausiai, šiame proceso etape aliuminis dega. Jai perdegus, mažėja liepsnos dydis, taigi ir degančio lašo dydis. Išdegusi dalelė šviečia ilgai.
Keisti degančios dalelės švytėjimo zonos dydį pagal aprašytą mechanizmą yra sudėtinga (2.7 pav.). Po uždegimo vertė rŠv. /r 0 greitai (per -0,1 ms) pasiekia didžiausią reikšmę (skyrius ab). Be to, pagrindiniu pirmojo degimo etapo laiku santykis r sv/ r 0 išlieka pastovus (skyrius bv). Kai magnio perdegimas baigiasi, r cv/ r 0 sumažinamas iki minimumo (taškas G), ir tada, prasidėjus aliuminio degimui, jis didėja (skyrius kur). Paskutinis, bet ne mažiau svarbus aliuminio perdegimas rŠv. /r 0 mažėja monotoniškai (skyrius de) iki galutinės vertės, atitinkančios susidariusio oksido dydį.

Ryžiai. 2.7.:
1 – lydinys 30% Al + 70% Mg, oras; 2 – lydinys 30% A1 + 70% Mg, mišinys 15% O2 + 85% Ar; 3 – lydinys 50% A1 + 50% Mg, oras
Aliuminio-magnio lydinių degimo proceso mechanizmas ir parametrai labai priklauso nuo lydinio sudėties. Sumažėjus magnio kiekiui lydinyje, mažėja švytėjimo zonos dydis pirmajame degimo etape ir šio etapo trukmė. Kai magnio kiekis lydinyje yra mažesnis nei 30%, procesas išlieka dviejų etapų, bet tampa nenutrūkstamas. Pirmojo etapo pabaigoje švytėjimo zona sumažinama iki pačios dalelės dydžio, degimo procesas sustoja, o aliuminis išdega tik dalelei vėl užsiliepsnojus. Dalelės, kurios neužsidega pakartotinai, yra tuščiaviduriai akytieji oksido apvalkalai, kurių viduje yra nesudegusio aliuminio lašeliai.
Dalelių degimo trukmės priklausomybė nuo jų pradinio skersmens išreiškiama šiomis empirinėmis formulėmis:

Aliuminio ir magnio lydinių deginimas deguonies ir argono mišiniuose, vandens garuose ir anglies dioksidu.
Aliuminio ir magnio lydinių dalelių degimo pobūdis deguonies ir argono mišiniuose yra toks pat kaip ir ore. Sumažėjus deguonies kiekiui, magnio perdegimo metu švytėjimo zonos dydis žymiai sumažėja. Lydinio 50% A1 + 50% Mg dalelių degimo trukmės priklausomybė nuo dalelių dydžio ir deguonies kiekio mišinyje tūrio procentais išreiškiama formule
Lydinių degimas vandens garuose gerokai skiriasi (2.8 pav.). Pirmojo etapo metu susidariusią oksido plėvelę sunaikina vandenilis, o dalelė įgauna koralo formą. Koraluose likęs aliuminis užsidega tik po 1–10 ms po pirmojo etapo pabaigos. Toks proceso nenutrūkstamumas būdingas bet kokios sudėties lydiniams.

Ryžiai. 2.8. Aliuminio-magnio lydinio (50:50) degimo dalelės sferinės(A) ir negeraib) susidaro vandens garų terpėje esant normaliam atmosferos slėgiui:
1 – pradinė dalelė; 2 – dalelė prieš uždegimą; 3 – magnio perdegimas; 4 - aliuminio perdegimas; 5 – po dalelės susidaręs koralas
Deginant aliuminio-magnio lydiniams anglies dioksidu, iš dalelės išdega tik magnis, po kurio degimo procesas sustoja.
Aliuminio-magnio lydinių deginimas aukštos temperatūros liepsnoje
Norint ištirti metalo dalelių degimo procesą aukštoje temperatūroje, po dalele, pasodinta ant adatos galiuko, iš amonio perchlorato ir urotropino mišinių buvo sudeginta presuota tabletė, skaičiuojant 2500, 2700 ir 3100 K degimo temperatūras.
Aliuminio ir magnio lydinių dalelės tokiomis sąlygomis paprastai dega sprogimu. Sprogimo buvimas būdingas visų kompozicijų dalelėms. Dėl sprogimo susidaro reikšminga švytėjimo zona, o tai rodo, kad vyrauja garų fazės degimas. Degančios dalelės nuotraukos degimo pradžioje (2.9 pav., A) rodo, kad heterogeninės reakcijos vyksta visame oksido apvalkalo paviršiuje. Dėl nevienalyčių reakcijų karščio metalas greitai išgaruoja (2.9 pav. b), prisidedant prie oksido apvalkalo plyšimo ir neišgaravusio lašo aptaškymo (2.9 pav., V).

Ryžiai. 2.9. 95% Al lydinio dalelių deginimas su 5% Mg oksiduojančioje liepsnoje (temperatūra 2700 K):
A- pradinis degimo etapas; b– stacionarus degimas; V- išsiskyrimas
Pasak B. G. Lrabey, S. E. Salibekov ir Yu. V. Leninsky, aliuminio ir magnio lydinių dalelių smulkinimą sukelia labai didelis magnio ir aliuminio virimo taškų skirtumas, dėl kurio magnio užvirimas, kai Aukštos temperatūros zonoje esanti dalelė yra sprogi ir gali sutraiškyti likusį aliuminį. 2500 K temperatūros jau pakanka sprogiam degimui, o tai gana natūralu, nes ši temperatūra viršija abiejų komponentų virimo temperatūrą.
- Arabey B. G., Salibekov S. E., Levinsky Yu. V. Kai kurios metalo dulkių užsidegimo ir degimo ypatybės // Miltelių metalurgija. 1964. Nr. 3. S. 109-118.
Norėdami suformuluoti vykstančių procesų dėsningumus, galime apsiriboti tik katijonų svarstymu, o anijonus neįtraukti, nes jie patys nedalyvauja reakcijoje. (Tačiau anijonų tipas turi įtakos nusėdimo greičiui.) Jei dėl paprastumo darome prielaidą, kad ir išsilaisvinę, ir ištirpę metalai yra dvivalečiai, galime parašyti:
Aš 1 + Aš 2 2+ => Aš 1 2+ + Aš 2
Be to, pirmajam eksperimentui Me 1 = Fe, Me 2 = Сu. Taigi, procesas susideda iš abiejų metalų atomų ir jonų keitimosi krūviais (elektronais). Jei atskirai nagrinėsime (kaip tarpines reakcijas) geležies tirpimą arba vario nusodinimą, gausime:
Fe => Fe 2+ + 2e -
Cu 2+ + 2e - => Cu
Dabar apsvarstykite atvejį, kai metalas panardinamas į vandenį arba druskos tirpalą, kurio katijonas neįmanomas dėl jo padėties įtampų serijoje. Nepaisant to, metalas linkęs tirpti jonų pavidalu. Šiuo atveju metalo atomas atiduoda du elektronus (jei metalas dvivalentis), į tirpalą panardinto metalo paviršius įkraunamas neigiamai tirpalo atžvilgiu, o sąsajoje susidaro dvigubas elektrinis sluoksnis. Šis potencialų skirtumas neleidžia tolesniam metalo tirpimui, todėl procesas greitai sustoja. Jei du skirtingi metalai panardinami į tirpalą, jie abu bus įkrauti, tačiau mažiau aktyvus yra šiek tiek silpnesnis dėl to, kad jo atomai yra mažiau linkę atskirti elektronus. Sujunkite abu metalus laidu. Dėl potencialų skirtumo elektronų srautas tekės iš aktyvesnio metalo į mažiau aktyvųjį, kuris sudaro teigiamą elemento polių. Vyksta procesas, kurio metu aktyvesnis metalas patenka į tirpalą, o katijonai iš tirpalo išsiskiria ant tauresnio metalo.
Galvaninio elemento esmė
Dabar keliais eksperimentais iliustruosime minėtą šiek tiek abstrakčią samprotavimą (kuris, be to, yra didelis supaprastinimas).
Pirmiausia į 250 ml talpos stiklinę iki vidurio pripilkite 10% sieros rūgšties tirpalo ir įmerkite ne per mažus cinko ir vario gabalėlius. Prie abiejų elektrodų lituojame arba sukniedžiame varinę vielą, kurios galai neturėtų liesti tirpalo.
Kol vielos galai nėra sujungti vienas su kitu, mes stebėsime cinko tirpimą, kurį lydi vandenilio išsiskyrimas. Cinkas, kaip matyti iš įtampos serijos, yra aktyvesnis už vandenilį, todėl metalas gali išstumti vandenilį iš joninės būsenos. Abu metalai sudaro elektrinį dvigubą sluoksnį. Potencialų skirtumą tarp elektrodų lengviausia nustatyti voltmetru. Iš karto po įrenginio įjungimo grandinėje rodyklė parodys maždaug 1 V, tačiau tada įtampa greitai nukris. Jei prie elemento, sunaudojančio 1 V įtampą, prijungsite nedidelę lemputę, tada ji užsidegs - iš pradžių gana stipriai, o tada švytėjimas taps silpnas.
Pagal prietaiso gnybtų poliškumą galime daryti išvadą, kad varinis elektrodas yra teigiamas polius. Tai galima įrodyti net ir be prietaiso, įvertinus proceso elektrochemiją. Nedidelėje stiklinėje arba mėgintuvėlyje paruošime prisotintą valgomosios druskos tirpalą, įpilame apie 0,5 ml fenolftaleino indikatoriaus alkoholio tirpalo ir į tirpalą panardiname abu viela uždarytus elektrodus. Netoli neigiamo poliaus bus pastebėta šiek tiek rausva spalva, kurią sukelia natrio hidroksido susidarymas prie katodo.
Kituose eksperimentuose į ląstelę galima sudėti įvairias metalų poras ir nustatyti gaunamą įtampą. Pavyzdžiui, magnis ir sidabras suteiks ypač didelį potencialų skirtumą dėl didelio atstumo tarp jų tam tikroje įtampoje, o cinkas ir geležis, priešingai, suteiks labai mažą, mažiau nei dešimtadalį volto. Naudodami aliuminį praktiškai negausime srovės dėl pasyvavimo.
Visi šie elementai arba, kaip sako elektrochemikai, grandinės, turi tą trūkumą, kad paėmus srovę labai greitai ant jų nukrenta įtampa. Todėl elektrochemikai šiuo metodu visada išmatuoja tikrąją įtampos vertę išjungtoje būsenoje įtampos kompensavimas, tai yra, lyginant ją su kito srovės šaltinio įtampa.
Leiskite mums išsamiau apsvarstyti procesus vario-cinko elemente. Katode cinkas patenka į tirpalą pagal šią lygtį:
Zn => Zn 2+ + 2е -
Sieros rūgšties vandenilio jonai išleidžiami ant vario anodo. Jie prijungia elektronus, ateinančius per laidą iš cinko katodo, ir dėl to susidaro vandenilio burbuliukai:
2H + + 2e - \u003d\u003e H2
Po trumpo laiko varis pasidengs plonu vandenilio burbuliukų sluoksniu. Tokiu atveju varinis elektrodas pavirs vandenilio elektrodu, o potencialų skirtumas sumažės. Šis procesas vadinamas poliarizacija elektrodas. Vario elektrodo poliarizaciją galima pašalinti po įtampos kritimo į elementą įpylus šiek tiek kalio bichromato tirpalo. Po to įtampa vėl padidės, nes kalio dichromatas oksiduos vandenilį į vandenį. Kalio dichromatas šiuo atveju veikia kaip depoliarizatorius.
Praktikoje naudojamos galvaninės grandinės, kurių elektrodai nėra poliarizuoti, arba grandinės, kurių poliarizaciją galima pašalinti pridedant depoliarizatorių.
Kaip nepoliarizuojamo elemento pavyzdį apsvarstykite Daniell elementą, kuris praeityje dažnai buvo naudojamas kaip srovės šaltinis. Tai taip pat vario-cinko elementas, tačiau abu metalai panardinami į skirtingus tirpalus. Cinko elektrodas dedamas į akytas molio kiaurymes, užpildytas praskiesta (apie 20%) sieros rūgštimi. Molio ląstelė yra suspenduota didelėje stiklinėje, kurioje yra koncentruotas vario sulfato tirpalas, o apačioje yra vario sulfato kristalų sluoksnis. Antrasis elektrodas šiame inde yra vario lakšto cilindras.
Šis elementas gali būti pagamintas iš stiklinio indelio, parduodamo molio elemento (kraštutiniais atvejais naudokite gėlių vazoną, uždarydami skylę apačioje) ir dviejų tinkamo dydžio elektrodų.
Elemento veikimo metu cinkas ištirpsta susidarant cinko sulfatui, o ant vario elektrodo išsiskiria metalinis varis. Bet tuo pačiu metu varinis elektrodas nėra poliarizuotas ir elementas duoda apie 1 V įtampą. Tiesą sakant, teoriškai įtampa gnybtuose yra 1,10 V, tačiau imant srovę matuojame šiek tiek mažesnę vertę, nes ląstelės elektrinei varžai.
Jei nepašaliname srovės iš elemento, turime išimti cinko elektrodą iš sieros rūgšties tirpalo, nes kitaip jis ištirps ir susidarys vandenilis.
Paprastos ląstelės, kuriai nereikia akytos pertvaros, schema parodyta paveikslėlyje. Cinko elektrodas yra stikliniame indelyje viršuje, o varinis elektrodas yra šalia apačios. Visa ląstelė užpildyta prisotintu natrio chlorido tirpalu. Į stiklainio dugną pilame saują vario sulfato kristalų. Gautas koncentruotas vario sulfato tirpalas labai lėtai maišysis su paprastosios druskos tirpalu. Todėl ląstelės veikimo metu ant vario elektrodo išsiskirs varis, o cinkas sulfato arba chlorido pavidalu ištirps viršutinėje ląstelės dalyje.
Dabar baterijos naudojamos beveik išimtinai sausi elementai kuriuos patogiau naudoti. Jų protėvis yra Leclancheto elementas. Elektrodai yra cinko cilindras ir anglies strypas. Elektrolitas yra pasta, kurią daugiausia sudaro amonio chloridas. Cinkas ištirpsta pastoje, o ant anglies išsiskiria vandenilis. Siekiant išvengti poliarizacijos, anglies strypas nuleidžiamas į lininį maišelį su anglies miltelių ir pirolizito mišiniu. Anglies milteliai padidina elektrodo paviršių, o pirolizitas veikia kaip depoliarizatorius, lėtai oksiduodamas vandenilį. Tiesa, piroliusito depoliarizuojantis gebėjimas yra silpnesnis nei anksčiau minėto kalio dichromato. Todėl, gavus srovę sausuose elementuose, įtampa greitai krenta, jie „pavargsta“ dėl poliarizacijos. Tik po kurio laiko įvyksta vandenilio oksidacija piroliusitu. Taigi elementai „ilsisi“, jei kurį laiką nepraleidžiama srovė. Tai patikrinkime ant žibintuvėlio baterijos, prie kurios prijungsime lemputę. Lygiagrečiai lempai, tai yra, tiesiai prie gnybtų, prijungiame voltmetrą. Iš pradžių įtampa bus apie 4,5 V. (Dažniausiai tokiuose akumuliatoriuose nuosekliai jungiami trys elementai, kurių kiekvieno teorinė įtampa yra 1,48 V.) Po kurio laiko įtampa kris, lemputė susilpnės. Skaitydami voltmetrą galime nuspręsti, kiek laiko turi ilsėtis baterija.
Ypatingą vietą užima regeneruojantys elementai, vadinami baterijomis. Juose vyksta grįžtamosios reakcijos, kurias galima įkrauti po elemento išsikrovimo prijungus prie išorinio nuolatinės srovės šaltinio.
Šiuo metu dažniausiai naudojami švino rūgšties akumuliatoriai; juose elektrolitas yra praskiesta sieros rūgštis, į kurią panardintos dvi švino plokštelės. Teigiamas elektrodas padengtas švino peroksidu PbO 2 (šiuolaikinis pavadinimas – švino dioksidas), neigiamas – metaliniu švinu. Įtampa gnybtuose yra maždaug 2,1 V. Iškrovimo metu ant abiejų plokščių susidaro švino sulfatas, kuris kraunant vėl virsta metaliniu švinu ir švino peroksidu.