Alyuminiy ochiq olovda yonadimi? Qanday qilib tekis olov rangini olish mumkin? Alyuminiy-magniy qotishmalarining havoda yonishi
Olovning rangi unda yonayotgan kimyoviy moddalar bilan aniqlanishini taxmin qilish qiyin emas, agar yuqori harorat ta'sirida yonuvchi moddalarning alohida atomlari ajralib chiqsa, olov rangga aylanadi. Moddalarning olov rangiga ta'sirini aniqlash uchun turli xil tajribalar o'tkazildi, biz ularni quyida muhokama qilamiz.
Qadim zamonlardan beri alkimyogarlar va olimlar olov olgan rangga qarab qanday moddalar yonishini aniqlashga harakat qilishgan.
Barcha uylar va kvartiralarda mavjud bo'lgan gazli suv isitgichlari va pechkalarning alangasi ko'k rangga ega. Kuyganda, bu soya uglerod, uglerod oksidi tomonidan ishlab chiqariladi. O'rmonda yoki uy gugurtlarida yoqilgan olov alangasining sariq-to'q sariq rangga ega bo'lishi tabiiy yog'ochda natriy tuzlarining ko'pligi bilan bog'liq. Bunga katta rahmat - qizil. Agar siz uni oddiy osh tuzi bilan sepsangiz, gaz plitasining olovi bir xil rangga ega bo'ladi. Mis yonganda, olov yashil bo'ladi. O'ylaymanki, siz uzoq vaqt davomida himoya birikmasi bilan qoplanmagan oddiy misdan yasalgan uzuk yoki zanjir kiyganingizda, terining yashil rangga aylanishini payqadingiz. Xuddi shu narsa yonish jarayonida sodir bo'ladi. Mis miqdori yuqori bo'lsa, oq bilan deyarli bir xil bo'lgan juda yorqin yashil chiroq paydo bo'ladi. Agar siz gaz pechiga mis talaşlarini sepsangiz, buni ko'rish mumkin.
Oddiy gaz gorelkasi va turli minerallar yordamida ko‘plab tajribalar o‘tkazildi. Shu tarzda ularning tarkibi aniqlandi. Mineralni cımbızla olib, olovga qo'yishingiz kerak. Yong'in oladigan rang elementdagi turli xil aralashmalarni ko'rsatishi mumkin. Yashil olov va uning soyalari mis, bor, molibden, surma va fosfor mavjudligini ko'rsatadi. Bor ko'k-yashil rang hosil qiladi. Selen olovga ko'k rang beradi. Olov stronsiy, litiy va kaltsiy, binafsha - kaliy ishtirokida qizil rangga ega. Sariq-to'q sariq rang natriy yonganda hosil bo'ladi.
Ularning tarkibini aniqlash uchun minerallarni o'rganish Bunsen burner yordamida amalga oshiriladi. Uning alangasining rangi bir tekis va rangsiz, tajriba jarayoniga xalaqit bermaydi. Bunsen 19-asrning o'rtalarida burnerni ixtiro qildi.
U moddaning tarkibini olov soyasiga qarab aniqlash imkonini beruvchi usulni o'ylab topdi. Olimlar undan oldin ham shunga o'xshash tajribalarni o'tkazishga harakat qilishgan, ammo ularda rangsiz alangasi tajribaning borishiga xalaqit bermagan Bunsen gorelkasi yo'q edi. U har xil elementlarni platinali simga o'choq oloviga qo'ydi, chunki bu metall qo'shilganda olov ranglanmaydi. Bir qarashda, usul yaxshi ko'rinadi, ko'p mehnat talab qiladigan kimyoviy tahlildan voz kechish mumkin. Siz shunchaki elementni olovga olib kelishingiz va u nimadan iboratligini ko'rishingiz kerak. Ammo sof shakldagi moddalar tabiatda juda kam uchraydi. Ular odatda olov rangini o'zgartiradigan ko'p miqdorda turli xil aralashmalarni o'z ichiga oladi.
Bunsen turli usullar yordamida ranglar va soyalarni ta'kidlashga harakat qildi. Masalan, rangli shishadan foydalanish. Aytaylik, agar siz ko'k oynadan qarasangiz, eng keng tarqalgan natriy tuzlarini yoqish paytida yonadigan sariq rangni ko'rmaysiz. Keyin kerakli elementning lilak yoki qip-qizil soyasi ajralib turadi. Ammo bunday nayranglar ham juda kam hollarda murakkab mineral tarkibini to'g'ri aniqlashga olib keldi. Bu texnologiya ko'proq narsaga erisha olmadi.
Hozirgi vaqtda bunday mash'al faqat lehimlash uchun ishlatiladi.
Olovlar turli xil ranglarda bo'ladi. Kaminga qarang. Yog'ochlarda sariq, to'q sariq, qizil, oq va ko'k olov raqsga tushadi. Uning rangi yonish haroratiga va yonuvchan materialga bog'liq. Buni tasavvur qilish uchun elektr pechkaning spiralini tasavvur qiling. Agar kafel o'chirilgan bo'lsa, spiral burilishlar sovuq va qora rangga ega. Aytaylik, siz sho'rvani isitishga va pechni yoqishga qaror qildingiz. Avvaliga spiral to'q qizil rangga aylanadi. Harorat qanchalik baland bo'lsa, spiralning qizil rangi shunchalik yorqinroq bo'ladi. Plitka maksimal haroratga yetganda, lasan to'q sariq-qizil rangga aylanadi.
Tabiiyki, spiral yonmaydi. Siz olovni ko'rmaysiz. U juda issiq. Agar siz uni yana qizdirsangiz, rangi o'zgaradi. Birinchidan, spiralning rangi sarg'ayadi, keyin oq rangga aylanadi va u yanada qizib ketganda, undan ko'k porlaydi.

Shunga o'xshash narsa olov bilan sodir bo'ladi. Misol tariqasida shamni olaylik. Sham alangasining turli joylari har xil haroratga ega. Olovga kislorod kerak. Agar shamni shisha idish bilan yopsangiz, olov o'chadi. Sham alangasining tayoqqa ulashgan markaziy maydoni ozgina kislorod iste'mol qiladi va qorong'i ko'rinadi. Olovning yuqori va yon qismlari ko'proq kislorod oladi, shuning uchun bu joylar yorqinroq bo'ladi. Olov tayoqchadan o'tganda, mum erib, mayda uglerod zarralariga bo'linadi. (Ko'mir ham ugleroddan iborat.) Bu zarralar olov tomonidan yuqoriga ko'tariladi va yonadi. Ular juda issiq va sizning kafelingizning spirali kabi porlaydilar. Ammo uglerod zarralari eng issiq plitkaning lasaniga qaraganda ancha issiqroq (uglerodning yonish harorati taxminan 1400 daraja Selsiy). Shuning uchun ularning porlashi sariq rangga ega. Yonayotgan tayoq yonida olov yanada qiziydi va ko'k rangda porlaydi.
Kamin yoki olov alangasi asosan rang-barang ko'rinishga ega. Yog'och shamdan pastroq haroratda yonadi, shuning uchun olovning asosiy rangi sariq emas, balki to'q sariq rangga ega. Yong'in alangasidagi ba'zi uglerod zarralari juda yuqori haroratga ega. Ulardan bir nechtasi bor, lekin ular olovga sarg'ish rang qo'shadilar. Issiq uglerodning sovutilgan zarralari bacalar ustida joylashgan kuydir. Yog'ochning yonish harorati shamning yonish haroratidan past. Kaltsiy, natriy va mis yuqori haroratgacha qizdirilganda turli xil ranglarda porlaydi. Ular bayramona salyut chiroqlarini ranglash uchun raketa kukuniga qo'shiladi.
Olovning rangi va kimyoviy tarkibi
Olovning rangi loglar yoki boshqa yonuvchan moddalar tarkibidagi kimyoviy aralashmalarga qarab farq qilishi mumkin. Olov tarkibida, masalan, natriy aralashmalari bo'lishi mumkin.

Qadim zamonlarda ham olimlar va alkimyogarlar olov rangiga qarab olovda qanday moddalar yonishini tushunishga harakat qilishgan.
- Natriy osh tuzining tarkibiy qismidir. Natriy qizdirilganda u yorqin sariq rangga aylanadi.
- Kaltsiy olovga chiqishi mumkin. Barchamiz bilamizki, sut tarkibida juda ko'p kaltsiy mavjud. Bu metall. Issiq kaltsiy yorqin qizil rangga aylanadi.
- Agar fosfor olovda yonsa, olov yashil rangga aylanadi. Bu elementlarning barchasi yog'ochda mavjud yoki boshqa moddalar bilan olovga kiradi.
- Deyarli har bir uyda gaz plitalari yoki suv isitgichlari bor, ularning olovi ko'k rangga ega. Buning sababi yonuvchan uglerod, uglerod oksidi, bu soyani beradi.

Olov ranglarini aralashtirish, kamalak ranglarini aralashtirish kabi, oq rang hosil qilishi mumkin, shuning uchun olov yoki kamin alangasida oq joylar ko'rinadi.
Ba'zi moddalarni yoqish paytida olov harorati:
Qanday qilib tekis olov rangini olish mumkin?
Minerallarni o'rganish va ularning tarkibini aniqlash uchun u ishlatiladi Bunsen burner, 19-asrning o'rtalarida Bunsen tomonidan ixtiro qilingan tajriba jarayoniga to'sqinlik qilmaydigan tekis, rangsiz olov rangini beradi.

Bunsen olov elementining ashaddiy muxlisi bo'lgan va ko'pincha alanga bilan ishlagan. Uning sevimli mashg'uloti shisha puflash edi. Shishadan turli xil ayyor dizayn va mexanizmlarni puflab, Bunsen og'riqni sezmadi. Ba'zida uning qo'zg'aluvchan barmoqlari issiq, hali ham yumshoq oynadan tutun chiqara boshlagan, lekin u bunga e'tibor bermagan. Agar og'riq allaqachon sezuvchanlik chegarasidan o'tib ketgan bo'lsa, u o'z usulini qo'llagan holda o'zini qutqardi - u quloq pardasini barmoqlari bilan mahkam bosib, bir og'riqni boshqasini to'xtatdi.
Aynan u moddaning tarkibini olov rangi bo'yicha aniqlash usulining asoschisi bo'lgan. Albatta, undan oldin olimlar bunday tajribalarni o'tkazishga harakat qilishgan, ammo ular tajribaga xalaqit bermaydigan rangsiz alangali Bunsen burneriga ega emas edilar. U platina simidagi turli elementlarni o'choq oloviga kiritdi, chunki platina olov rangiga ta'sir qilmaydi va uni rang bermaydi.
Ko'rinishidan, usul yaxshi, murakkab kimyoviy tahlil qilishning hojati yo'q, elementni olovga keltiring va uning tarkibi darhol ko'rinadi. Lekin u erda yo'q edi. Tabiatda juda kamdan-kam hollarda moddalar sof shaklda topiladi, ular odatda rangini o'zgartiradigan turli xil aralashmalarning katta qismini o'z ichiga oladi.
Bunsen ranglar va ularning soyalarini ajratishning turli usullarini sinab ko'rdi. Masalan, men rangli oynadan qarashga harakat qildim. Aytaylik, ko'k shisha eng keng tarqalgan natriy tuzlari tomonidan ishlab chiqarilgan sariq rangni o'chiradi va tabiiy elementning qip-qizil yoki binafsha rangini farqlash mumkin. Ammo bu nayranglar yordamida ham yuztadan bir marta murakkab mineral tarkibini aniqlash mumkin edi.
Bu qiziq! Atomlar va molekulalarning ma'lum rangdagi yorug'lik chiqarish xususiyati tufayli moddalarning tarkibini aniqlash usuli ishlab chiqildi. spektral tahlil. Olimlar moddaning chiqaradigan spektrini, masalan, yonganda, uni ma'lum elementlarning spektrlari bilan taqqoslaydilar va shu bilan uning tarkibini aniqlaydilar.

Alyuminiyni yoqish
Alyuminiyning havoda yonishi
Magniydan farqli o'laroq, bitta alyuminiy zarralari havoda yoki suv bug'ida 2100 K gacha qizdirilganda yonmaydi. Yonayotgan magniy zarralari alyuminiyni yoqish uchun ishlatilgan. Ikkinchisi isitish elementining yuzasiga joylashtirildi va alyuminiy zarralari igna uchida birinchisidan 10-4 m masofada joylashgan.
Alyuminiy zarralari yondirilganda, bug 'fazasida olov paydo bo'ladi va zarracha atrofida paydo bo'ladigan porlash zonasining intensivligi asta-sekin o'sib boradi. Statsionar yonish porlash zonasining mavjudligi bilan tavsiflanadi, bu metall deyarli butunlay yonib ketguncha uning hajmini o'zgartirmaydi. Yorqinlik zonasi va zarracha o'lchamlari nisbati 1,6-1,9 ni tashkil qiladi. Yorqinlik zonasida kichik oksidli tomchilar hosil bo'ladi, ular to'qnashuvda birlashadi.
Zarrachaning yonishidan keyingi qoldiq ichida metall bo'lmagan ichi bo'sh qobiqdir. Zarrachaning yonish vaqtining uning kattaligiga bog'liqligi formula (simmetrik yonish) bilan ifodalanadi.
Alyuminiyning suv bug'ida yonishi
Alyuminiyning suv bug'ida yonishi heterojen tarzda sodir bo'ladi. Reaktsiya paytida chiqarilgan vodorod oksid plyonkasini yo'q qilishga yordam beradi; bu holda suyuq alyuminiy oksidi (yoki gidroksid) diametri 10-15 mikrongacha bo'lgan tomchilar shaklida püskürtülür. Oksid qobig'ining bunday yo'q qilinishi vaqti-vaqti bilan takrorlanadi. Bu shuni ko'rsatadiki, metallning sezilarli qismi zarracha yuzasida yonadi.
Yonishning boshida rsv nisbati /r 0 1,6-1,7 ga teng. Yonish jarayonida zarrachalar hajmi kamayadi, gs/?o nisbati esa 2,0-3,0 gacha oshadi. Alyuminiy zarrasining suv bug'ida yonish tezligi havodagidan deyarli 5 baravar ko'p.
Alyuminiy-magniy qotishmalarining yonishi
Alyuminiy-magniy qotishmalarining havoda yonishi
O'zgaruvchan tarkibdagi alyuminiy-magniy qotishmalarining zarralari havoda, kislorod-argon aralashmalarida, suv bug'ida va karbonat angidridda yonishi, qoida tariqasida, magniy zarralarining yonishi kabi davom etadi. Yonish boshlanishidan oldin sirtda sodir bo'ladigan oksidlanish reaktsiyalari sodir bo'ladi.
Alyuminiy-magniy qotishmalarining yonishi alyuminiy va magniyning yonishidan sezilarli darajada farq qiladi va qotishma tarkibidagi komponentlarning nisbati va oksidlovchi muhit parametrlariga kuchli bog'liqdir. Qotishma zarralarini yoqishning eng muhim xususiyati ikki bosqichli jarayondir (2.6-rasm). Birinchi bosqichda zarracha mash'alalar to'plami bilan o'ralgan bo'lib, reaktsiya mahsulotlarining lyuminestsensiyasining bir xil bo'lmagan zonasini hosil qiladi. Yonishning birinchi bosqichida qotishma zarrachasini o'rab turgan yorug'lik zonasining tabiati va hajmini yonayotgan magniy zarrasi atrofidagi yorug'lik zonasining tabiati va o'lchami bilan solishtirganda (2.4-rasmga qarang), biz ushbu bosqichda, asosan, magniy, degan xulosaga kelishimiz mumkin. zarrachadan yonib ketadi.

Guruch. 2.6. Oddiy atmosfera bosimida 30% Al + 70% Mg qotishma zarrachasining hajmi 15% O ni o'z ichiga olgan aralashmada yonishi. 2va 85% Ar:
1, 2 – magniyning yonishi; 3-6 – alyuminiyning yonishi
Qotishma yonishning birinchi bosqichining o'ziga xos xususiyati zarrachalar hajmi va olov zonasining doimiyligidir. Bu qotishmaning suyuq tomchisi qattiq oksidli qobiq ichida joylashganligini anglatadi. Oksid plyonkasida magniy oksidi ustunlik qiladi. Kino nuqsonlari orqali magniy oqadi, bug 'fazali diffuziya alangasida yonadi.
Birinchi bosqichning oxirida geterogen reaktsiyalarning paydo bo'lishi kuchayadi, bu zarracha yuzasida yorqin luminesans o'choqlarining paydo bo'lishidan dalolat beradi. Geterogen reaktsiyalar paytida chiqarilgan issiqlik zarrachani oksidning erish nuqtasiga va yonishning ikkinchi bosqichining boshlanishiga qadar qizdirishga yordam beradi.
Yonishning ikkinchi bosqichida zarracha bir xil, yorqinroq porlash zonasi bilan o'ralgan bo'lib, metall yonib ketganda u kamayadi. Olov zonasining bir xilligi va sharsimonligi zarracha yuzasidagi oksid plyonkasi eriganligini ko'rsatadi. Film orqali metallning tarqalishi suyuq oksidning past diffuziya qarshiligi bilan ta'minlanadi. Olov zonasining kattaligi zarracha hajmidan sezilarli darajada oshadi, bu bug 'fazasida metallning yonishini ko'rsatadi. Yonishning ikkinchi bosqichining tabiatini alyuminiy yonishning ma'lum namunasi bilan taqqoslash katta o'xshashlikni ko'rsatadi, ehtimol alyuminiy jarayonning ushbu bosqichida yonadi. U yonib ketganda, olovning o'lchami va, natijada, yonish tomchisi kamayadi. Kuygan zarracha uzoq vaqt davomida porlaydi.
Ta'riflangan mexanizmga muvofiq yonayotgan zarrachaning porlash zonasi hajmini o'zgartirish murakkab (2.7-rasm). Yonishdan keyin qiymat r St. /r 0 tezlikda (-0,1 ms ichida) maksimal qiymatga etadi (bo'lim ab). Bundan tashqari, yonishning birinchi bosqichining asosiy vaqtida nisbati r St/ r 0 doimiy bo'lib qoladi (bo'lim bv). Magniyning yonishi tugagach, r Rezyume/ r 0 minimal darajaga tushiriladi (nuqta G), va keyin alyuminiy yonishi boshlanishi bilan u kuchayadi (bo'lim gd). Nihoyat, lekin alyuminiy yonib ketadi r St. /r 0 monoton ravishda kamayadi (bo'lim de) hosil bo'lgan oksidning o'lchamiga mos keladigan yakuniy qiymatga.

Guruch. 2.7.:
1 – qotishma 30% Al + 70% Mg, havo; 2 – qotishma 30% A1 + 70% Mg, aralashma 15% O2 + 85% Ar; 3 – qotishma 50% A1 + 50% Mg, havo
Alyuminiy-magniy qotishmalarining yonish jarayonining mexanizmi va parametrlari sezilarli darajada qotishma tarkibiga bog'liq. Qotishma tarkibidagi magniy miqdori kamayishi bilan yonishning birinchi bosqichida porlash zonasining kattaligi va bu bosqichning davomiyligi kamayadi. Qotishma tarkibidagi magniy miqdori 30% dan kam bo'lsa, jarayon ikki bosqichli jarayon bo'lib qoladi, lekin intervalgacha bo'ladi. Birinchi bosqichning oxirida porlash zonasi zarrachaning o'lchamiga kamayadi, yonish jarayoni to'xtaydi va alyuminiy zarracha qayta yoqilgandan keyingina yonib ketadi. Qayta yonmaydigan zarralar ichi yonmagan alyuminiy tomchilarini o'z ichiga olgan ichi bo'sh, g'ovakli oksidli qobiqlardir.
Zarrachalarning yonish vaqtining ularning boshlang'ich diametriga bog'liqligi quyidagi empirik formulalar bilan ifodalanadi:

Alyuminiy-magniy qotishmalarining kislorodning argon bilan aralashmalarida, suv bug'ida va karbonat angidridda yonishi.
Kislorod-argon aralashmalarida alyuminiy-magniy qotishmalarining zarrachalarining yonish tabiati havodagi kabi. Kislorod miqdorining pasayishi bilan magniyning yonishi paytida porlash zonasining hajmi sezilarli darajada kamayadi. 50% Al + 50% Mg qotishmasi zarrachalarining yonish vaqtining zarracha hajmiga va aralashmadagi kislorod miqdoriga bog'liqligi foiz nisbatida formula bilan ifodalanadi.
Qotishmalarning suv bug'ida yonishi sezilarli darajada farq qiladi (2.8-rasm). Birinchi bosqichda hosil bo'lgan oksid plyonkasi vodorod tomonidan yo'q qilinadi va zarracha marjon ko'rinishini oladi. Marjonda qolgan alyuminiy birinchi bosqich tugagandan so'ng faqat 1-10 ms yonadi. Jarayonning bunday uzilishlari har qanday tarkibdagi qotishmalarga xosdir.

Guruch. 2.8. Alyuminiy-magniy qotishma zarralarining yonishi (50:50) sharsimon(A) va noto'g'ri(b) Oddiy atmosfera bosimida suv bug'ida hosil bo'ladi:
1 – boshlang‘ich zarracha; 2 - yonishdan oldin zarracha; 3 - magniyning yonishi; 4 - alyuminiyning yonishi; 5 - zarrachadan keyin hosil bo'lgan mercan
Alyuminiy-magniy qotishmalari karbonat angidridda yonganda, zarrachadan faqat magniy yonib ketadi, shundan so'ng yonish jarayoni to'xtaydi.
Alyuminiy-magniy qotishmalarining yuqori haroratli olovda yonishi
Yuqori haroratlarda metall zarrachalarining yonish jarayonini o'rganish uchun igna uchiga o'rnatilgan zarracha ostida yonish harorati 2500, 2700 va 3100 K bo'lgan ammoniy perxlorat va geksamin aralashmalarining presslangan plansheti yondirildi.
Alyuminiy-magniy qotishmalarining zarralarini bu sharoitda yonishi, qoida tariqasida, portlash bilan sodir bo'ladi. Portlashning mavjudligi barcha kompozitsiyalarning zarralari uchun xosdir. Portlash natijasida sezilarli luminesans zonasi hosil bo'ladi, bu bug 'fazasi yonishining ustunligi belgisidir. Yonish boshida yonayotgan zarrachaning fotosuratlari (2.9-rasm, A) oksid qobig'ining butun yuzasida geterogen reaktsiyalar sodir bo'lishini ko'rsatadi. Geterogen reaktsiyalarning issiqligi tufayli metallning tez bug'lanishi sodir bo'ladi (2.9-rasm, b), oksidi qobig'ining yorilishi va bug'lanmagan tomchining chayqalishiga yordam beradi (2.9-rasm, V).

Guruch. 2.9. 95% Al qotishma zarrachasining yonishi oksidlovchi olovda 5% Mg bilan (harorat 2700 K):
A- yonishning dastlabki bosqichi; b- statsionar yonish; V- bo'linish
B. G. Lrabey, S. E. Salibekov va Yu. V. Leninskiylarning fikricha, alyuminiy-magniy qotishmalarining zarrachalarini maydalash magniy va alyuminiyning qaynash temperaturalarining juda katta farqi tufayli yuzaga keladi, buning natijasida zarracha magniyning qaynashiga olib keladi. yuqori haroratli zonada bo'lsa, portlovchi va qolgan alyuminiyning maydalanishiga olib keladi. Portlovchi yonish sodir bo'lishi uchun 2500 K harorat allaqachon etarli, bu juda tabiiy, chunki bu harorat ikkala komponentning qaynash nuqtasidan oshadi.
- Arabey B. G., Solibekov S. E., Levinskiy Yu. V. Metall changni yoqish va yoqishning ba'zi xususiyatlari // Chang metallurgiyasi. 1964. No 3. B. 109-118.
Davom etayotgan jarayonlarning qonuniyatlarini shakllantirish uchun biz o'zimizni kationlarni ko'rib chiqish bilan cheklashimiz va anionlarni istisno qilishimiz mumkin, chunki ularning o'zlari reaktsiyada qatnashmaydi. (Ammo cho‘kish tezligiga anionlarning turi ta’sir qiladi.) Agar soddalik uchun ajralib chiqqan va erigan metallar ikki valentli deb faraz qilsak, quyidagicha yozishimiz mumkin:
Men 1 + Men 2 2+ => Men 1 2+ + Men 2
Bundan tashqari, birinchi tajriba uchun Me 1 = Fe, Me 2 = Cu. Shunday qilib, jarayon ikkala metalning atomlari va ionlari o'rtasida zaryad (elektron) almashinuvidan iborat. Agar biz temirning erishi yoki misning cho'ktirilishini (oraliq reaktsiyalar sifatida) alohida ko'rib chiqsak, biz quyidagilarni olamiz:
Fe => Fe 2+ + 2e -
Su 2+ + 2e - => Su
Endi metallni suvga yoki tuz eritmasiga botirganda, kationi kuchlanish qatoridagi o'rni tufayli almashinib bo'lmaydigan holatni ko'rib chiqing. Shunga qaramay, metall ion shaklida eritmaga kirishga intiladi. Bunda metall atomi ikkita elektrondan voz kechadi (agar metall ikki valentli bo'lsa), eritmaga botgan metall yuzasi eritmaga nisbatan manfiy zaryadlanadi va interfeysda qo'sh elektr qavat hosil bo'ladi. Bu potentsial farq metallning keyingi erishini oldini oladi, shuning uchun jarayon tez orada to'xtaydi. Agar probirkaga ikki xil metall botirilsa, ularning ikkalasi ham zaryadlanadi, lekin faolligi biroz zaifroq bo'ladi, chunki uning atomlari elektronni yo'qotishga kamroq moyil bo'ladi. Ikkala metallni o'tkazgich bilan bog'laymiz. Potensiallar farqi tufayli elektronlar oqimi faolroq metalldan kamroq faol bo'lgan metallga oqib o'tadi, bu elementning musbat qutbini tashkil qiladi. Jarayon sodir bo'ladi, bunda faolroq metall eritmaga kiradi va eritmadagi kationlar qimmatroq metallga chiqariladi.
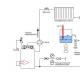
Galvanik hujayraning mohiyati
Keling, yuqorida keltirilgan ma'lum bir mavhum fikrni bir nechta tajribalar bilan ko'rsatamiz (bu qo'shimcha ravishda, qo'pol soddalashtirishni anglatadi).
Birinchidan, 250 ml hajmdagi stakanni o'rtasiga sulfat kislotaning 10% eritmasi bilan to'ldiring va unga juda kichik bo'lmagan rux va mis bo'laklarini botiring. Biz ikkala elektrodga mis simni lehimlaymiz yoki perchin qilamiz, ularning uchlari eritmaga tegmasligi kerak.
Simning uchlari bir-biriga bog'lanmagan ekan, biz vodorodning chiqishi bilan birga bo'lgan sinkning erishini kuzatamiz. Rux, kuchlanish seriyasidan kelib chiqqan holda, vodorodga qaraganda faolroqdir, shuning uchun metall vodorodni ion holatidan siqib chiqarishi mumkin. Ikkala metallda ham elektr qo'sh qavat hosil bo'ladi. Elektrodlar orasidagi potentsial farqni aniqlashning eng oson yo'li voltmetrdir. Qurilmani kontaktlarning zanglashiga olib ulagandan so'ng, strelka taxminan 1 V ni ko'rsatadi, ammo keyin kuchlanish tezda pasayadi. Agar siz elementga 1 V quvvat sarflaydigan kichik lampochkani ulasangiz, u yonadi - dastlab juda kuchli, keyin esa porlash zaiflashadi.
Qurilma terminallarining polaritesiga asoslanib, biz mis elektrodning ijobiy qutb ekanligi haqida xulosa qilishimiz mumkin. Bu jarayonning elektrokimyosini hisobga olgan holda qurilmasiz isbotlanishi mumkin. Kichik stakan yoki probirkada osh tuzining to`yingan eritmasini tayyorlaymiz, unga 0,5 ml ga yaqin fenolftalein indikatorining spirt eritmasidan solib, eritma ichiga sim bilan yopilgan ikkala elektrodni botiramiz. Salbiy qutb yaqinida zaif qizg'ish rang kuzatiladi, bu katodda natriy gidroksid hosil bo'lishidan kelib chiqadi.
Boshqa tajribalarda hujayraga turli juft metallarni joylashtirish va natijada paydo bo'lgan kuchlanishni aniqlash mumkin. Masalan, magniy va kumush ular orasidagi sezilarli masofa va bir qator kuchlanish tufayli juda katta potentsial farqni beradi, rux va temir esa, aksincha, voltning o'ndan biridan kam bo'lgan juda kichikni beradi. Alyuminiydan foydalangan holda, biz passivatsiya tufayli deyarli hech qanday oqim olmaymiz.
Bu elementlarning barchasi yoki elektrokimyogarlar aytganidek, kontaktlarning zanglashiga olib keladigan kamchiliklari shundaki, oqimni o'lchashda ulardagi kuchlanish juda tez tushadi. Shuning uchun elektrokimyogarlar har doim bu usul yordamida kuchlanishning haqiqiy qiymatini energiyasiz holatda o'lchaydilar kuchlanish kompensatsiyasi, ya'ni uni boshqa oqim manbaining kuchlanishi bilan solishtirish.
Keling, mis-sink elementidagi jarayonlarni biroz batafsilroq ko'rib chiqaylik. Katodda rux quyidagi tenglama bo'yicha eritmaga kiradi:
Zn => Zn 2+ + 2e -
Mis anodida sulfat kislotaning vodorod ionlari chiqariladi. Ular sink katodidan sim orqali keladigan elektronlarni biriktiradilar va natijada vodorod pufakchalari hosil bo'ladi:
2N + + 2e - => N 2
Qisqa vaqt o'tgach, mis vodorod pufakchalari bilan yupqa qatlam bilan qoplanadi. Bunday holda, mis elektrod vodorodga aylanadi va potentsial farq kamayadi. Bu jarayon deyiladi qutblanish elektrod. Mis elektrodning polarizatsiyasini kuchlanish pasayganidan keyin hujayraga ozgina kaliy dixromat eritmasini qo'shish orqali yo'q qilish mumkin. Shundan so'ng, kuchlanish yana kuchayadi, chunki kaliy dixromati vodorodni suvga oksidlaydi. Kaliy bikromat bu holda ishlaydi depolarizator
Amalda elektrodlari qutblanmagan galvanik sxemalar yoki polarizatsiyasini depolarizatorlarni qo'shish orqali bartaraf etilishi mumkin bo'lgan sxemalar qo'llaniladi.
Polarizatsiya qilinmaydigan elementga misol sifatida, o'tmishda hozirgi manba sifatida tez-tez ishlatilgan Doniyor elementini ko'rib chiqing. Bu ham mis-sink elementidir, lekin ikkala metall ham turli xil eritmalarga botiriladi. Sink elektrodi suyultirilgan (taxminan 20%) sulfat kislota bilan to'ldirilgan gözenekli gil hujayraga joylashtiriladi. Loy xujayrasi mis sulfatning konsentrlangan eritmasini o'z ichiga olgan katta stakanda to'xtatiladi va pastki qismida mis sulfat kristallari qatlami mavjud. Ushbu idishdagi ikkinchi elektrod mis qatlamdan yasalgan silindrdir.
Ushbu element shisha idishdan, sotuvda mavjud bo'lgan gil hujayradan (o'ta og'ir holatlarda biz gul idishidan foydalanamiz, pastki qismdagi teshikni yopamiz) va mos o'lchamdagi ikkita elektroddan tayyorlanishi mumkin.
Hujayraning ishlashi davomida sink sink sulfat hosil qilish uchun eriydi va mis elektrodida metall mis ajralib chiqadi. Lekin shu bilan birga, mis elektrod polarizatsiya qilinmaydi va element taxminan 1 V kuchlanish hosil qiladi. Aslida, nazariy jihatdan, terminallardagi kuchlanish 1,10 V ni tashkil qiladi, lekin oqimni yig'ishda biz elektr toki tufayli bir oz pastroq qiymatni o'lchaymiz. hujayraning qarshiligi.
Agar biz elementdan oqimni olib tashlamasak, biz sulfat kislota eritmasidan sink elektrodni olib tashlashimiz kerak, chunki aks holda u vodorod hosil qilish uchun eriydi.
G'ovakli bo'linishni talab qilmaydigan oddiy hujayraning diagrammasi rasmda ko'rsatilgan. Sink elektrod shisha idishning yuqori qismida, mis elektrod esa pastki qismida joylashgan. Butun hujayra stol tuzining to'yingan eritmasi bilan to'ldiriladi. Idishning pastki qismiga bir hovuch mis sulfat kristallarini qo'ying. Olingan konsentrlangan mis sulfat eritmasi osh tuzi eritmasi bilan juda sekin aralashadi. Shuning uchun hujayra ishlaganda mis elektrodda mis ajralib chiqadi va sink hujayraning yuqori qismida sulfat yoki xlorid shaklida eriydi.
Hozirgi kunda ular deyarli faqat batareyalar uchun ishlatiladi. quruq elementlar, ulardan foydalanish qulayroq. Ularning ajdodi Leclanche elementidir. Elektrodlar sink tsilindri va uglerod tayog'idir. Elektrolit asosan ammoniy xloriddan iborat pastadir. Rux xamirda eriydi va ko'mirda vodorod ajralib chiqadi. Polarizatsiyani oldini olish uchun uglerod tayoqchasi ko'mir kukuni va piroluzit aralashmasini o'z ichiga olgan zig'ir sumkasiga botiriladi. Uglerod kukuni elektrod sirtini oshiradi va piroluzit vodorodni asta-sekin oksidlovchi depolarizatsiya vazifasini bajaradi. To'g'ri, piroluzitning depolarizatsiya qobiliyati avval aytib o'tilgan kaliy bikromatdan ko'ra zaifroq. Shuning uchun, quruq elementlarda oqim qabul qilinganda, kuchlanish tezda pasayadi, ular polarizatsiya tufayli "chayqaladi". Biroz vaqt o'tgach, vodorodning oksidlanishi piroluzit bilan sodir bo'ladi. Shunday qilib, bir muncha vaqt oqim o'tkazilmasa, elementlar "dam oladi". Keling, buni lampochkani ulaydigan chiroq batareyasida tekshirib ko'raylik. Biz voltmetrni chiroqqa parallel ravishda, ya'ni to'g'ridan-to'g'ri terminallarga ulaymiz. Dastlab, kuchlanish taxminan 4,5 V bo'ladi. (Ko'pincha bunday batareyalar ketma-ket ulangan uchta hujayradan iborat bo'lib, ularning har biri nazariy kuchlanishi 1,48 V.) Biroz vaqt o'tgach, kuchlanish pasayadi va lampochkaning porlashi paydo bo'ladi. zaiflashtirmoq. Voltmetr ko'rsatkichlariga asoslanib, batareya qancha vaqt dam olishi kerakligini aniqlashimiz mumkin.
Batareyalar deb nomlanuvchi regeneratsiya qiluvchi elementlar alohida o'rin egallaydi. Ular teskari reaksiyalarga kirishadi va tashqi doimiy oqim manbaiga ulanish orqali hujayra zaryadsizlangandan keyin qayta zaryadlanishi mumkin.
Hozirgi vaqtda qo'rg'oshin kislotali akkumulyatorlar eng keng tarqalgan; Ulardagi elektrolitlar suyultirilgan sulfat kislota bo'lib, unga ikkita qo'rg'oshin plitasi botiriladi. Ijobiy elektrod qo'rg'oshin peroksid PbO 2 (zamonaviy nomi qo'rg'oshin dioksidi) bilan qoplangan, salbiy elektrod metall qo'rg'oshindir. Terminallardagi kuchlanish taxminan 2,1 V ni tashkil qiladi. Bo'shatish paytida ikkala plastinkada qo'rg'oshin sulfat hosil bo'ladi, u zaryad olayotganda yana metall qo'rg'oshin va qo'rg'oshin peroksidga aylanadi.